题目内容
6.下列有关化学用语表示正确的是( )| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: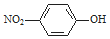 | D. | H2S的电子式: |
分析 A.链节指组成聚合物的每一基本重复结构单元,聚丙烯为 ,所以聚丙烯的链节为:-CH2CH(CH3)-;
,所以聚丙烯的链节为:-CH2CH(CH3)-;
B.分子式是指用元素符号表示纯净物(单质、化合物)分子的组成及相对分子质量的化学式,乙酸的分子式为C2H4O2,结构简式为CH3COOH;
C.对硝基苯酚中的硝基应该是N与C相连接,而不是O与C相连;
D.电子式的书写首先要认清物质中由什么键组成,共价键是原子之间通过共用电子的方式成键,离子键是阴阳离子之间形成的,在形式上有本质区别.H2S为共价化合物.
解答 解:A.聚丙烯为 ,所以聚丙烯的链节为:-CH2CH(CH3)-,故A正确;
,所以聚丙烯的链节为:-CH2CH(CH3)-,故A正确;
B.乙酸的分子式为C2H4O2,选项中CH3COOH表示结构简式,故B错误;
C.对硝基苯酚中的硝基应该是N与C相连接,而不是O与C相连,故C错误;
D.H2S为共价化合物,选项中的电子式的形式表示的是离子化合物,故D错误.
故选:D.
点评 本题主要考查化学用语的基础知识,需要学生对基本的化学用语要特别的熟练.

练习册系列答案
相关题目
17.1摩尔丙烷在光照情况下,最多可以与几摩尔氯气发生取代反应( )
| A. | 4mol | B. | 8mol | C. | 10mol | D. | 2mol |
17. 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
分别取它们的水溶液进行实验,结果如下:①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:ACuSO4;CBa(OH)2.
(2)写出步骤②中发生反应的化学方程式2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(3)D溶液中滴入石蕊试液,现象是由无色变成红色,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是500mL.
(5)现用500mL 3mol•L-1的E溶液充分吸收11.2L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+).
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水).
 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:ACuSO4;CBa(OH)2.
(2)写出步骤②中发生反应的化学方程式2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(3)D溶液中滴入石蕊试液,现象是由无色变成红色,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是500mL.
(5)现用500mL 3mol•L-1的E溶液充分吸收11.2L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+).
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水).
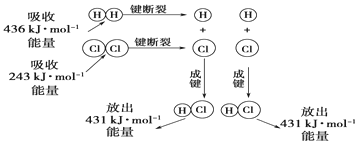
1.化学资料表明:H-H、O=O、H-O键的键能分别是436kJ•mol-1、496kJ•mol-1和462kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1,则C(s)+H2O(g)=CO(g)+H2(g)的反应热为( )
| A. | -332kJ | B. | -118kJ | C. | +130kJ•mol-1 | D. | +350kJ•mol-1 |
11.对下列物质的用途解释正确的是( )
| A. | “神州11号”用Na2O2作氧气的来源,是因为Na2O2能氧化CO2和水产生O2 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作,是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 氨常用作制冷剂利用了氨的化学性质 |
18.某校化学甲、乙两个小组学生利用下图所列装置进行“铁与水反应及相关性质”的实验.(图中夹持及尾气处理装置均已略去)
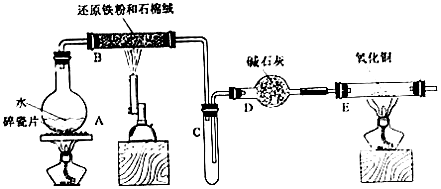
(1)烧瓶底部放置了几片碎瓷片,碎资片的作用是防暴沸.装置B中发生反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4H2+Fe3O4.
(2)如果要在E处玻璃管处点燃该气体,则必须对该气体进行验纯装置中的现象是黑色变为紫红色,试管口有水珠生成..
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
①乙组得到的黑色粉末是FeO.
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
③乙组步骤4中,溶液变红的原因为Cl2+2Fe2+=2Fe3++2Cl-,Fe3++SCN-=FeSCN2+;溶液褪色可能的原因是氯水将SCN-氧化破坏了;验证方法为继续向溶液中滴入KSCN溶液,溶液变红即可证明.
(4)其中一组同学将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL.5mol•L-1FeSO4溶液和5.2g固体沉淀物,则原Fe2(SO4)3溶液的物质的量浓度为0.1mol/L;将沉淀物过滤后,该组同学又向清液中滴加稀硝酸,观察到有NO气体生成,发生的化学反应方程式为6FeSO4+8HNO3=2Fe2(SO4)3+2NO↑+4H2O+2Fe(NO3)3.

(1)烧瓶底部放置了几片碎瓷片,碎资片的作用是防暴沸.装置B中发生反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4H2+Fe3O4.
(2)如果要在E处玻璃管处点燃该气体,则必须对该气体进行验纯装置中的现象是黑色变为紫红色,试管口有水珠生成..
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 | |
| 1 | 取黑色粉末加入稀盐酸 | 洛解,无气泡 | 溶解,无气泡 | |
| 2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 | |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 | |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 | |
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
③乙组步骤4中,溶液变红的原因为Cl2+2Fe2+=2Fe3++2Cl-,Fe3++SCN-=FeSCN2+;溶液褪色可能的原因是氯水将SCN-氧化破坏了;验证方法为继续向溶液中滴入KSCN溶液,溶液变红即可证明.
(4)其中一组同学将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL.5mol•L-1FeSO4溶液和5.2g固体沉淀物,则原Fe2(SO4)3溶液的物质的量浓度为0.1mol/L;将沉淀物过滤后,该组同学又向清液中滴加稀硝酸,观察到有NO气体生成,发生的化学反应方程式为6FeSO4+8HNO3=2Fe2(SO4)3+2NO↑+4H2O+2Fe(NO3)3.
3.下列关于金属铝的叙述中,不正确的是( )
| A. | Al是地壳中含量最多的金属元素,但铝是使用较晚的金属 | |
| B. | Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 | |
| C. | Al箔在空气中受热可以熔化,且发生剧烈燃烧 | |
| D. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落 |