题目内容
16.在标准状况下,1体积水溶解672体积氨气,所得溶液密度为0.9g•cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为( )| A. | 17.9mol•L-1 34.7% | B. | 20.4mol•L-1 33.8% | ||
| C. | 17.9mol•L-1 33.8% | D. | 20.4mol•L-1 34.7% |
分析 NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质,设水的体积为1L,则氨气的体积为672L,由标准状况下的体积可计算氨气的物质的量,溶液质量=氨气质量+水的质量,溶液体积可由溶液的质量和密度来计算,再根据质量分数定义、物质的量浓度的定义计算.
解答 解:NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质,
设水的体积为1L,氨气的体积为672L,则氨气的物质的量为$\frac{672L}{22.4L/mol}$=30mol,
溶液的质量为1000g+30mol×17g/mol=1510g,
溶液的体积为$\frac{1510g}{900g/L}$=1.7L,
则氨水的质量分数为w=$\frac{30mol×17g/mol}{1510g}$×100%=33.8%,
氨水的物质的量浓度为c=$\frac{30mol}{1.7L}$=17.9mol•L-1,
故选C.
点评 本题考查学生物质的量浓度和质量分数的计算,难度中等,溶液的体积计算是解答本题的关键也是学生解答本题的易错点.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
7.下列各组物质,一定是同系物的是( )
| A. | 分子式为C4H6和C5H8的烃 | B. | 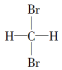 和 和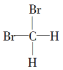 | ||
| C. | 符合CnH2n通式的烃 | D. | 分子式为C4H10和C20H42的烃 |
7.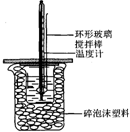 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失.
(2)不能(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒.其原因是金属导热,导致热量散失.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是偏低(填“偏高”“偏低”或“无影响”).
(4)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”“减少”或“不变”),理由是后者生成0.055molH2O,而前者只能生成0.050molH2O;所求中和热数值不变(填“增加”“减少”或“不变”),理由是中和热是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关;
(5)不能(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值.该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.184×10-3kJ/(g•℃),则该反应的中和热为△H=-56.5kJ/mol(保留小数点后一位).
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失.
(2)不能(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒.其原因是金属导热,导致热量散失.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是偏低(填“偏高”“偏低”或“无影响”).
(4)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”“减少”或“不变”),理由是后者生成0.055molH2O,而前者只能生成0.050molH2O;所求中和热数值不变(填“增加”“减少”或“不变”),理由是中和热是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关;
(5)不能(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值.该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 过量的SO2通入NaOH溶液中:SO2-+2OH-=SO32-+H2O | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
11.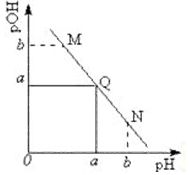 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A. | 溶液导电能力M点大于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | 图中b>7 |
1.化学资料表明:H-H、O=O、H-O键的键能分别是436kJ•mol-1、496kJ•mol-1和462kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1,则C(s)+H2O(g)=CO(g)+H2(g)的反应热为( )
| A. | -332kJ | B. | -118kJ | C. | +130kJ•mol-1 | D. | +350kJ•mol-1 |
5.下列除去杂质的方法正确的是( )
| A. | 除去乙烷中少量的乙烯:气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤、分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰、蒸馏 |
6. 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )| A. | 原氨水浓度x=0.01mol•L-1 | |
| B. | m、p两点溶液中由水电离出来的c(OH-):m>p | |
| C. | n点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 若在m点溶液中加少量水,[c(NH3•H2O)•c(H+)]/c(NH4+)不变 |
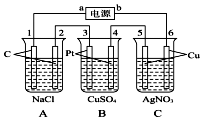 如图,通电5min后,电极5的质量增加2.16g,回答:
如图,通电5min后,电极5的质量增加2.16g,回答: