题目内容
17.现有以下物质①NaCl晶体;②铝;③CaCO3固体;④酒精;⑤NH3;⑥熔化的KNO3 ⑦盐酸(1)以上物质属于电解质的是①③⑥
(2)以上物质属于非电解质的是④⑤
(3)以上物质在该状态下能导电的是:②⑥⑦.
分析 (1)在水溶液中或熔融状态下能导电的化合物为电解质;
(2)在水溶液中和熔融状态下均不能导电的化合物为非电解质;
(3)物质有自由移动的电子或离子则能导电.
解答 解:①NaCl晶体不能导电,是电解质;
②铝能导电,是单质,既不是电解质也不是非电解质;
③CaCO3固体不能导电,是电解质;
④酒精不能导电,是非电解质;
⑤NH3不能导电,是非电解质;
⑥熔化的KNO3能导电,是电解质;
⑦盐酸能导电,是混合物,故既不是电解质也不是非电解质.
(1)综上分析可知,是电解质的是①③⑥,故答案为:①③⑥;
(2)综上分析可知,是非电解质的是④⑤,故答案为:④⑤;
(3)综上分析可知,能导电的是②⑥⑦,故答案为:②⑥⑦.
点评 本题考查了电解质、非电解质和物质导电的判断,难度不大,应注意的是能导电的不一定是电解质,电解质不一定能导电.

练习册系列答案
相关题目
7.以MnO2为原料发生反应制得的MnCl2溶液,其中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2.根据上述实验事实,下列分析正确的是( )
| A. | MnS的溶解度小于PbS、CuS、CdS等硫化物的溶解度 | |
| B. | 除杂试剂MnS也可用Na2S替代 | |
| C. | MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
8.下列叙述不正确的是( )
| A. | 碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行 | |
| B. | 在温度、压强一定的条件下,自发反应总是向△G=△H-T△S<0的方向进行 | |
| C. | 水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行 | |
| D. | 混乱度减小的吸热反应一定不能自发进行 |
5.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol.下列说法不正确的是( )
| A. | 降低温度,H2S浓度减小,表明该反应是放热反应 | |
| B. | 通入CO后,逆反应速率逐渐增大,直至再次平衡 | |
| C. | 反应前H2S物质的量为6mol | |
| D. | CO的平衡转化率为20% |
12.在标准状况下有:①6.72L CH4,②3.01×1023个HCl分子,③13.6g H2S,④0.2mol NH3.下列对这四种气体的描述不正确的是( )
| A. | 体积 ②>③>①>④ | B. | 密度 ②>③>④>① | ||
| C. | 质量 ②>③>④>① | D. | 氢原子个数 ①>③>④>② |
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
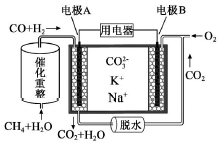

| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$ 3H2+CO,每消耗1molCH4转移12mol 电子 |
9.假如你是卫生防疫人员,为配制0.01mol•L-1的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是( )
| A. | 称量时,左盘高,右盘低 | |
| B. | 定溶时俯视容量瓶刻度线 | |
| C. | 原容量瓶洗净后未干燥 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
7.对于某些离子的检验及结论一定正确的是( )
| A. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,推断溶液中含有NH4+ | |
| B. | 无色试液在焰色反应中呈黄色,推断试液是钠盐溶液,不含钾盐 | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,推断溶液中含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,推断溶液中含有SO42- |