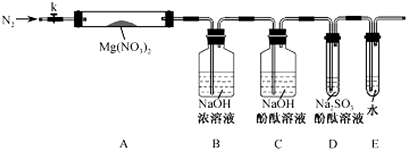
题目内容
6.有一样品,其中只含Na2CO3•10H2O和NaHCO3,为测定样品中Na2CO3的质量分数,请从如图中选用适当的实验装置,设计一个最简单的实验,测定样品中Na2CO3的质量分数.请填写下列空白.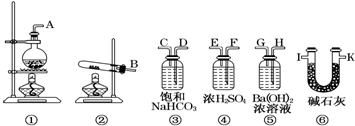
(1)应选用的装置是(只写装置的标号,装置不重复使用):②⑤⑥,所选用装置的连接顺序是(填接口的字母):B接H,G接I,.接..
(2)停止加热时,正确的操作是应先将B接口和H接口分开.
(3)实验装置中盛碱石灰的U型管的作用是防止空气的二氧化碳被氢氧化钡溶液吸收而影响实验的准确性.
(4)取W g样品实验,经测定W g样品在加热时,可得a g CO2,则W g样品中所含Na2CO3的质量分数为$\frac{11W-42a}{11W}$.
分析 根据装置图可知,为测定样品中Na2CO3的质量分数,先将样品在试管中加热,将生成气体通往氢氧化钡溶液中,根据氢氧化钡溶液质量的质量的增加可知二氧化碳的质量,根据二氧化碳的质量可知样品中碳酸氢钠的质量,进而确定碳酸钠的质量,再计算质量分数,为了防止空气的二氧化碳被氢氧化钡溶液吸收,在装有氢氧化钡溶液装置的后面再连接装有碱石灰的干燥管,据此答题.
解答 解:根据装置图可知,为测定样品中Na2CO3的质量分数,先将样品在试管中加热,将生成气体通往氢氧化钡溶液中,根据氢氧化钡溶液质量的质量的增加可知二氧化碳的质量,根据二氧化碳的质量可知样品中碳酸氢钠的质量,进而确定碳酸钠的质量,再计算质量分数,为了防止空气的二氧化碳被氢氧化钡溶液吸收,在装有氢氧化钡溶液装置的后面再连接装有碱石灰的干燥管,
(1)根据上面的分析可知,该实验所需要的装置是②⑤⑥,所选用装置的连接顺序是B接H,G接I,
故答案为:②⑤⑥;B接H,G接I;
(2)为防止倒吸,停止加热时,应先将B接口和H接口分开,
故答案为:应先将B接口和H接口分开;
(3)实验装置中盛碱石灰的U型管的作用是防止空气的二氧化碳被氢氧化钡溶液吸收而影响实验的准确性,
故答案为:防止空气的二氧化碳被氢氧化钡溶液吸收而影响实验的准确性;
(4)根据碳酸氢钠分解的方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑可知,生成a g CO2时,则分解掉的碳酸氢钠的质量为$\frac{84×2}{44}×ag$=$\frac{42}{11}a$g,所以W g样品中所含Na2CO3的质量分数为$\frac{Wg-\frac{42}{11}ag}{Wg}$=$\frac{11W-42a}{11W}$,
故答案为:$\frac{11W-42a}{11W}$.
点评 本题考查较为综合,以钠的化合物为载体,综合考查学生实验能力和分析能力,注意把握物质的性质以及实验原理,为解答该题的关键,题目难度中等.


| A. | 曲线a和b表示两个反应过程的反应热不同 | |
| B. | 曲线a一定表示反应是在无催化剂时的反应过程 | |
| C. | 增大压强,X的转化率一定增大 | |
| D. | 反应达平衡,升高温度,平衡常数K值一定减小 |
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少 |
| A. | 25℃时,0.1mol•L-1的三种溶液的pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 | |
| C. | 25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大 | |
| D. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
(1)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+有(填“有”或“无”)颜色.
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
A.PFS中铁显+3价
B.铁原子的外围电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| 元素 | Mn | Fe | |
| 电离能 | I1 | 717 | 759 |
| (kJ•mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 | |
①该化合物中存在的化学键类型有配位键、共价键、离子键.
②甲基丙烯酸分子中C原子的杂化方式有sp3和sp2.
③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是H2S(填一种即可).
④与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是K、Cu(填元素符号).
| A. | 合成氨生产过程中将NH3液化分离,减小氨气的浓度会导致化学平衡向左移动 | |
| B. | 合成氨工业中,使用铁催化剂可加快正反应速率,提高N2、H2的转化率 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
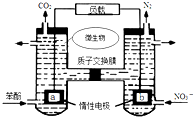
| A. | a电极发生还原反应 | |
| B. | H+由右室通过质子交换膜进入左室 | |
| C. | b电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 电池工作时,电流由a电极沿导线流向b电极 |
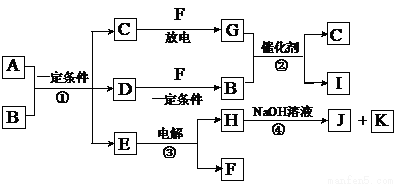
 含元素均为第二周期元素
含元素均为第二周期元素 。反应②常用于汽车尾气的处理。
。反应②常用于汽车尾气的处理。