题目内容
16.一种微生物燃料电池如图所示,下列关于该电池说法正确的是( )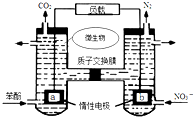
| A. | a电极发生还原反应 | |
| B. | H+由右室通过质子交换膜进入左室 | |
| C. | b电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 电池工作时,电流由a电极沿导线流向b电极 |
分析 A、b极上N元素的化合价降低,所以b是正极发生还原反应,a是负极,发生氧化反应;
B、原电池中阳离子从负极移向正极;
C、b极上N元素的化合价降低,所以b是正极发生还原反应;
D、原电池中电流从正极流向负极,据此回答.
解答 解:A、b极上N元素的化合价降低,所以b是正极发生还原反应,故A错误;
B、原电池中阳离子从负极移向正极,即H+由左室通过质子交换膜进入右室,故B错误;
C、b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,故C正确;
D、原电池中电流从正极流向负极,电流由b电极沿导线流向a电极,故D错误.
故选C.
点评 本题考查化学电源新型电池,为高频考点,所有燃料电池中负极上都是燃料失电子、正极上都是氧化剂得电子,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为学习难点.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
4.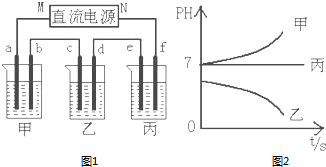 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.
接通电源,经过一段时间后,测得乙中c电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图2.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”),甲、乙电解质分别为NaCl、AgNO3(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积1.4L.
(3)写出乙烧杯的电解池总反应4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+4Ag+O2↑.
(4)若电解后甲溶液的体积为25L,则该溶液的pH为12.
(5)要使丙恢复到原来的状态,应加入2.25gH2O.(填写化学式)
 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
接通电源,经过一段时间后,测得乙中c电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图2.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”),甲、乙电解质分别为NaCl、AgNO3(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积1.4L.
(3)写出乙烧杯的电解池总反应4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+4Ag+O2↑.
(4)若电解后甲溶液的体积为25L,则该溶液的pH为12.
(5)要使丙恢复到原来的状态,应加入2.25gH2O.(填写化学式)
11.下列说法正确的是( )
| A. | 某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 | |
| B. | 雾霾成因与田间焚烧秸秆和燃烧煤炭无关 | |
| C. | SO2能使溴水褪色,也能高锰酸钾溶液褪色,都体现了SO2的漂白性 | |
| D. | 常温下,浓硫酸和浓硝酸可以用铝槽车或铁槽车装运 |
5.下列实验操作、实验现象、解释或结论不对应的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将蘸有浓硫酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 无明显现象 | 氨气与硫酸不反应 |
| B | 用干净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃片可以看到紫色的火焰 | 该溶液中有钾离子 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐消失 | 氯化铵受热分解 |
| A. | A | B. | B | C. | C | D. | D |
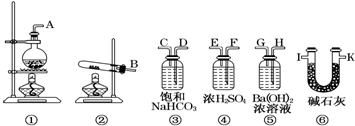
 某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.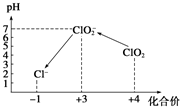 Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.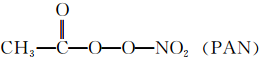 等二次污染物.
等二次污染物. 钛(Ti)被称为继铁、铝之后的第三金属.
钛(Ti)被称为继铁、铝之后的第三金属.