题目内容
1.下列有关说法不正确的是( )| A. | 25℃时,0.1mol•L-1的三种溶液的pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 | |
| C. | 25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大 | |
| D. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
分析 A、电解质溶液:①Na2CO3 溶液中碳酸根离子水解显碱性,②NaHCO3 溶液中碳酸氢根离子水解显碱性,③CH3COONa 醋酸根离子水解显碱性,对应的酸越弱水解程度越大,溶液的PH值越大;
B、pH=-lgc(H+),pH相等则氢离子浓度相等;
C、碳酸钠溶液中加入氢氧化钡生成溶度积小的BaCO3,所以BaCO3纯水中的KSP比在Na2CO3溶液中的KSP小;
D、根据电荷守恒分析解答.
解答 解:A、酸性CH3COOH>H2CO3>HCO3-,所以pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa),故A正确;
B、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)=10-pH,两种溶液的pH相等,所以其c(H+)相等,故B正确;
C、碳酸钠溶液中加入氢氧化钡生成溶度积小的BaCO3,所以BaCO3纯水中的KSP比在Na2CO3溶液中的KSP小,而不是大,故C错误;
D、NaHCO3和Na2CO3混合溶液中阴阳离子的种类相同,根据电荷守恒一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选C.
点评 本题考查溶度积、酸碱混合溶液定性判断、盐类水解等知识点,学生要掌握溶液酸碱性与对应的酸越弱水解程度越大,溶液的PH值越大.

练习册系列答案
相关题目
12.在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| C. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| D. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
9.下列说法中一定正确的是( )
| A. | pH=7的溶液呈中性 | |
| B. | pH值为0的溶液中c(H+)=0 mol/L | |
| C. | pH=5的溶液中[H+]=1.0×10-5 mol•L-1 | |
| D. | pH=5的溶液中[OH-]=1.0×10-9 mol•L-1 |
16.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向溶液中加入足量的溴水,反应后溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 肯定不含Cu2+ | D. | 肯定不含SO32- |
13.下列有关离子方程式的书写正确的是( )
| A. | NaHCO3溶液和盐酸;CO32-+2H+═H2O+CO2↑ | |
| B. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ | |
| C. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-═Al2S3↓ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: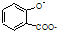 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
11.下列说法正确的是( )
| A. | 某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 | |
| B. | 雾霾成因与田间焚烧秸秆和燃烧煤炭无关 | |
| C. | SO2能使溴水褪色,也能高锰酸钾溶液褪色,都体现了SO2的漂白性 | |
| D. | 常温下,浓硫酸和浓硝酸可以用铝槽车或铁槽车装运 |

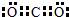 ,Z3+的原子结构示意图为
,Z3+的原子结构示意图为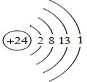
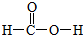 ,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.
,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.