题目内容
3.在25℃、101KPa时,1g乙醇(C2H5OH)完全燃烧生成CO2和液态水时放热29.2kJ,则能表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1343.2kJ/mol.C.分析 依据1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,结合燃烧热的定义计算求出1mol乙醇完全燃烧放出的热量,然后写出热化学方程式.
解答 解:1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为:46×29.2kJ=1343.2kJ/mol,其燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1343.2kJ•mol-1;
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1343.2 kJ•mol-1.
点评 本题考查了燃烧热的概念以及燃烧热的热化学方程式的书写,注意燃烧热的热化学方程式中可燃物的物质的量为1mol,产物必须是稳定的氧化物.

练习册系列答案
相关题目
14.有一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料电池的说法不正确的是( )
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的总反应是 2C4H10+13O2=8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为 O2+4e-=2O2- | |
| D. | 通入丁烷的一极是负极,电极反应为 C4H10+13O2-+26e-=4CO2+5H2O |
11.将BaO2放入密闭的真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡.保持温度不变,体积压缩为原来的一半,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | |
| B. | 平衡逆向移动,氧气的物质的量浓度减小 | |
| C. | 体系的压强不变 | |
| D. | BaO2的量增加 |
18.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1mol•L-1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)为( )
| A. | 0.15mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1? |
8.在不同条件下分别测得反应2A(g)+3B(g)$?_{△}^{催化剂}$C(g)+2D(g)的化学反应速率,其中表示该反应进行的最快的是( )
| A. | v(A)=3 mol•L-1•min-1 | B. | v(B)=6 mol•L-1•min-1 | ||
| C. | v(C)=2.5 mol•L-1•min-1 | D. | v(D)=4 mol•L-1•min-1 |
15.下列现象或变化过程与胶体的性质无关的是( )
| A. | 清晨森林中的道道光柱 | B. | 明矾净水 | ||
| C. | 海水的淡化 | D. | 河流入海处易形成沙洲 |
12.下列说法正确的是( )
| A. |  的一溴代物和 的一溴代物和  的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | C5H11Cl有3种同分异构体 | |
| C. | 按系统命名法,化合物  的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一直线上 |
13.一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为( )
| A. | 1.2mol/(L•min) | B. | 1.8 mol/(L•min) | C. | 0.6mol/(L•min) | D. | 2.4mol/(L•min) |
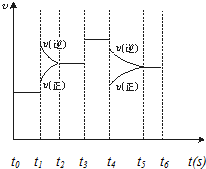 在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题: