题目内容
8.在不同条件下分别测得反应2A(g)+3B(g)$?_{△}^{催化剂}$C(g)+2D(g)的化学反应速率,其中表示该反应进行的最快的是( )| A. | v(A)=3 mol•L-1•min-1 | B. | v(B)=6 mol•L-1•min-1 | ||
| C. | v(C)=2.5 mol•L-1•min-1 | D. | v(D)=4 mol•L-1•min-1 |
分析 化学反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{3}{2}$=1.5;
B.$\frac{6}{3}$=1.2;
C.$\frac{2.5}{1}$=2.5;
D.$\frac{4}{2}$=2,
显然C中比值最大,反应速率最快,
故选C.
点评 本题考查反应速率的比较,为高频考点,把握速率与化学计量数成正比为解答的关键,侧重分析与计算能力的考查,注意比值法应用及速率单位统一,题目难度不大.

练习册系列答案
相关题目
18. 乙烯(C2H4结构式:
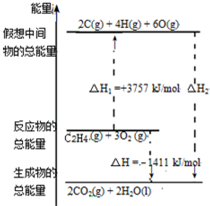
乙烯(C2H4结构式: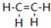 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
 乙烯(C2H4结构式:
乙烯(C2H4结构式: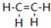 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)| A. | 542 | B. | 391 | C. | 1834 | D. | 917 |
13.几种短周期元素的原子半径及主要化合价如表:
已知X是短周期中最活泼的金属,且与R同周期.下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6、-2 | +5、-3 | -2 | +3 |
| A. | 离子半径大小:R3+<X+<M2- | |
| B. | Y与M组成的化合物是光化学烟雾的原因之一 | |
| C. | 将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 | |
| D. | R的单质是铝热剂的成分之一 |
17.下列有关说法正确的是( )
| A. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 | |
| B. | 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g);△H<0,则该反应一定能自发进行 | |
| D. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
18.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | 盐酸与NaOH溶液反应的中和热△H=-57.3kJ•mol-1,则硫酸和Ca(OH)2溶液反应的中和热△H=-2×57.3kJ•mol-1 | |
| D. | 一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,则有N2(g)+3H2(g)?2NH3(g)△H=-80kJ•mol-1 |
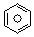 (l)的燃烧热为3267.5kJ•mol-1,
(l)的燃烧热为3267.5kJ•mol-1,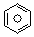 (l)+6O2(g)═6CO2(g)+3H2(g)
(l)+6O2(g)═6CO2(g)+3H2(g)