题目内容
18.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1mol•L-1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)为( )| A. | 0.15mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1? |
分析 溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),根据溶液电荷守恒计算.
解答 解:根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),而溶液中c(OH-)很小,可以忽略不计,
则有3c(Al3+)+c(K+)+c(H+)=2c(SO42-),所以:c(K+)=2c(SO42-)-3c(Al3+)-c(H+),
c(K+)═2×0.8mol/L-3×0.4mol/L-0.1mol/L=0.3mol/L;
故选C.
点评 本题考查溶液物质的量浓度的计算,题目难度不大,可利用电荷守恒计算.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
8.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表.
(1)反应前4min的平均速率v(CO2)=0.225 mol/(L.min)
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
| t/min | 1 | 4 | 8 | 11 |
| n(H2)mol | 6 | 2.6 | 2 | 2 |
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
9.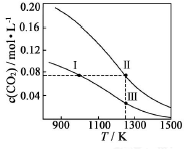 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ) | |
| C. | 体系中c(CO2):c(CO2,状态Ⅱ)<3c(CO2,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
6.从海带中提取碘的实验过程,正确的是( )

| A. | ①将海带灼烧成灰 | B. | ②过滤海带灰得到含I-的溶液 | ||
| C. | ③放出碘的苯溶液 | D. | ④分离碘并回收苯 |
7.常温下,下列有关离子浓度及pH大小的比较正确的是( )
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7 | |
| D. | pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7 |
8.下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法.其中正确的是( )
| 选项 | A | B | C | D |
| 物质 | KNO3溶液 | CO2 | 水 | 乙醇 |
| 杂质 | KOH | H2O(g) | 溴 | 水 |
| 除杂试剂 | FeCl3溶液 | 浓硫酸 | 酒精 | 生石灰 |
| 除杂装置 | 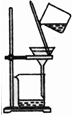 | 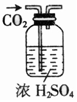 | 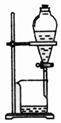 | 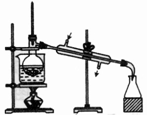 |
| A. | A | B. | B | C. | C | D. | D |