题目内容
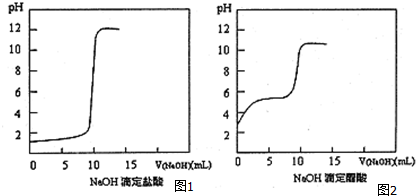
13.一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为( )| A. | 1.2mol/(L•min) | B. | 1.8 mol/(L•min) | C. | 0.6mol/(L•min) | D. | 2.4mol/(L•min) |
分析 2min内,N2的物质的量由20mol减小到8mol,则△c=$\frac{12mol}{10L}$=1.2mol/L,结合v=$\frac{△c}{△t}$计算,反应速率之比等于化学方程式计量数之比计算氢气的反应速率.
解答 解:一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则△c=$\frac{12mol}{10L}$=1.2mol/L,v(N2)=$\frac{1.2mol/L}{2min}$=0.6mol/(L•min),则2min内H2的反应速率v(H2)=3v(N2)=1.8 mol/(L•min),
故选B.
点评 本题考查化学反应速率的计算,明确反应速率的计算表达式即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
8.下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法.其中正确的是( )
| 选项 | A | B | C | D |
| 物质 | KNO3溶液 | CO2 | 水 | 乙醇 |
| 杂质 | KOH | H2O(g) | 溴 | 水 |
| 除杂试剂 | FeCl3溶液 | 浓硫酸 | 酒精 | 生石灰 |
| 除杂装置 | 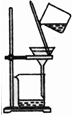 | 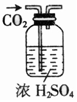 | 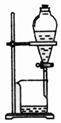 |  |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | 盐酸与NaOH溶液反应的中和热△H=-57.3kJ•mol-1,则硫酸和Ca(OH)2溶液反应的中和热△H=-2×57.3kJ•mol-1 | |
| D. | 一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,则有N2(g)+3H2(g)?2NH3(g)△H=-80kJ•mol-1 |




 .
.