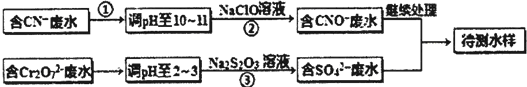
题目内容
15.下列事实不能用元素周期律解释的是( )| A. | 气态氢化物的稳定性:HBr>HI | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| D. | Mg、Al与同浓度盐酸反应,Mg更剧烈 |
分析 A.非金属性越强,氢化物越稳定;
B.金属性越强,最高价氧化物水化物碱性越强;
C.向Na2SO3溶液中加盐酸,发生强酸制取弱酸的反应;
D.金属性越强,与酸反应越剧烈.
解答 解:A.非金属性Br>I,氢化物稳定性:HBr>HI,能用元素周期律解释,故A正确;
B.金属性Na>Li,0.1 mol•L-1溶液的pH:NaOH>LiOH,能用元素周期律解释,故B正确;
C.向Na2SO3溶液中加盐酸,发生强酸制取弱酸的反应,不能用元素周期律解释,故C错误;
D.金属性Mg>Al,Mg与酸反应剧烈,能用元素周期律解释,故D正确;
故选C.
点评 本题考查物质的性质及元素周期律,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.如图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是( )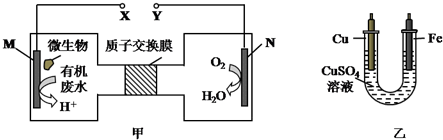

| A. | H十透过质子交换膜由左向右移动 | |
| B. | 铜电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16g |
6.下列实验装置图与对应的现象或结论的叙述均正确的是( )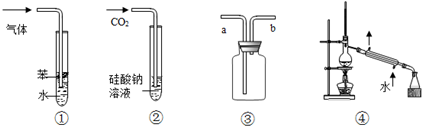

| A. | 装置①:可用于吸收NH3或HCl气体,并防止倒吸 | |
| B. | 装置②:持续通入CO2气体,先出现白色沉淀,后变澄清 | |
| C. | 装置③:若“a进b出”可用于收集NO2,若“b进a出”可用于收集NH3 | |
| D. | 装置④:可用于分离石油,得到汽油、煤油和柴油等各种纯净物 |
20.室温下,分别用0.1mol•L-1溶液进行下列实验,结论不正确的是( )
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
6.已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-═I3-.通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数.
某同学为测定上述平衡体系中c(I2),采用如下方法:取V1mI平衡混合溶液,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3═2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).下列对该同学设计方案的分析,正确的是( )
某同学为测定上述平衡体系中c(I2),采用如下方法:取V1mI平衡混合溶液,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3═2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).下列对该同学设计方案的分析,正确的是( )
| A. | 方案可行.能准确测定溶液中的c(I2) | |
| B. | 方案可行,可采用淀粉做该滴定反应的指示剂 | |
| C. | 不可行.只能测得溶液中c(I2)与c(I3-)之和 | |
| D. | 不可行.因为I-能与Na2S2O3发生反应 |
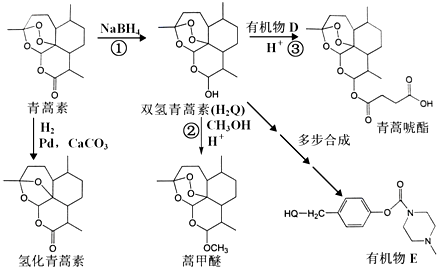
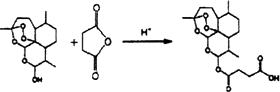 .
.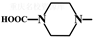 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.