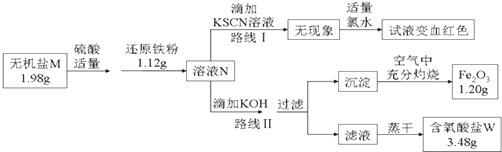
题目内容
5.如图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是( )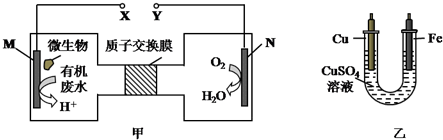
| A. | H十透过质子交换膜由左向右移动 | |
| B. | 铜电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16g |
分析 根据题给信息知,该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,根据得失电子守恒计算,以此解答该题.
解答 解:该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,
A.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,故A正确;
B.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,故B正确;
C.H2NCONH2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+,故C正确;
D.当N电极消耗0.25mol氧气时,则转移0.25×4=1.0mol电子,所以铁电极增重$\frac{1.0}{2}$mol×64g/mol=32g,故D错误.
故选D.
点评 本题考查了原电池原理以及电镀原理,为高频考点,侧重于学生的分析、计算能力的考查,明确原电池正负极上得失电子、电解质溶液中阴阳离子移动方向即可解答,难度中等.

练习册系列答案
相关题目
15.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molFeI2与1molCl2反应时转移的电子数为3NA | |
| B. | 2g H218O与D216O的混合物中所含中子、电子数目均为NA | |
| C. | 273K,101kPa下,28g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | pH=1的H2SO4溶液10L,含H+的数目为2NA |
16.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为NA/11.2 | |
| B. | 将lmol Cl2通人水中,HClO、Cl一、ClO-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4 NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |
17.下列做法中,利用了氧化还原反应原理的是( )
| A. | 用活性炭吸附新装修居室里的有害气体 | |
| B. | 用K2Cr2O7检查司机是否酒后驾车 | |
| C. | 用盐酸清洗陶瓷面盆上的铁锈迹 | |
| D. | 用石灰水吸收燃煤烟气中的SO2 |
14.下列说法不正确的是( )
| A. | 煤的气化、煤的液化和煤的干馏均属于化学变化 | |
| B. | 淀粉、纤维素、油脂、蛋白质均属于高分子化合物 | |
| C. | 棉花、羊毛和蚕丝都属于天然高分子 | |
| D. | 陶瓷、水泥和玻璃均属于硅酸盐材料 |
15.下列事实不能用元素周期律解释的是( )
| A. | 气态氢化物的稳定性:HBr>HI | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| D. | Mg、Al与同浓度盐酸反应,Mg更剧烈 |