题目内容
6.已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-═I3-.通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数.某同学为测定上述平衡体系中c(I2),采用如下方法:取V1mI平衡混合溶液,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3═2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).下列对该同学设计方案的分析,正确的是( )
| A. | 方案可行.能准确测定溶液中的c(I2) | |
| B. | 方案可行,可采用淀粉做该滴定反应的指示剂 | |
| C. | 不可行.只能测得溶液中c(I2)与c(I3-)之和 | |
| D. | 不可行.因为I-能与Na2S2O3发生反应 |
分析 Na2S2O3与碘发生氧化还原反应,可使平衡I2+I-═I3-逆向移动,由Na2S2O3的物质的量可计算原溶液中n(I2)与n(I3-)之和,以此解答该题.
解答 解:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-?I3-,I-不能与Na2S2O3发生反应,碘溶液呈紫色,滴定终点溶液变为无色,可不用淀粉作为指示剂,
测定的是碘单质和I3-的含量,不能准确测定溶液中的c(I2),只有C符合,
故选C.
点评 本题考查物质的含量的测定,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握平衡移动的特点以及反应的原理,难度不大.

练习册系列答案
相关题目
14.下列说法不正确的是( )
| A. | 煤的气化、煤的液化和煤的干馏均属于化学变化 | |
| B. | 淀粉、纤维素、油脂、蛋白质均属于高分子化合物 | |
| C. | 棉花、羊毛和蚕丝都属于天然高分子 | |
| D. | 陶瓷、水泥和玻璃均属于硅酸盐材料 |
15.下列事实不能用元素周期律解释的是( )
| A. | 气态氢化物的稳定性:HBr>HI | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| D. | Mg、Al与同浓度盐酸反应,Mg更剧烈 |
18.X、Y、Z、W、R属于短周期主族元素.X的原子半径是短周期主族元素中最大的,Y元素的单质通过分离液态空气得到,Z元素的单质是常见的半导体材料,W与Z同族,R与Y同族,其单质有杀菌作用.下列叙述不正确的是
( )
( )
| A. | 与Z同族的第五周期元素的原子序数为50 | |
| B. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| C. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| D. | 由W和Z组成的ZW物质硬度大、熔沸点高,具有导磁性 |
15.化学与生产、生活、社会密切相关.下列说法正确的是( )
| A. | 长期放置的漂白粉是因与空气中的氧气发生反应而变质 | |
| B. | 粗硅提纯是利用H2作还原剂,将硅从其氯化物中还原出来 | |
| C. | 利用半透膜除去海水中的NaCl、MgCl2等离子化合物可获得淡水 | |
| D. | 工业上用铝热反应来冶炼Fe、Cr、Mn、V等稀有金属 |
16.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法正确的是( )
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl3溶液(FeCl2溶液) | 铜粉 | 过滤 |
| B | CO2(SO2) | NaHCO3溶液 | 洗气 |
| C | HCl(Cl2) | 饱和食盐水 | 洗气 |
| D | NH4Cl固体(I2固体) | -- | 加热至质量不再变化 |
| A. | A | B. | B | C. | C | D. | D |

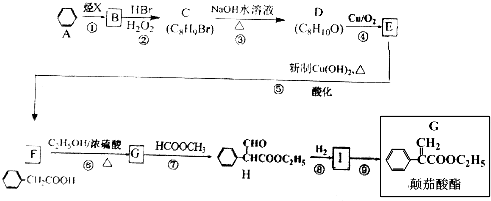
 ;
;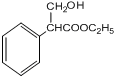 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$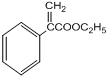 +H2O;
+H2O; 、
、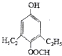
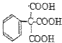 的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.