题目内容
10.某工厂的镀铜废水中含有CN-和Cr2O72一离子,需要处理达标后才能排放.该厂拟用如图流程进行废水处理,回答下列问题: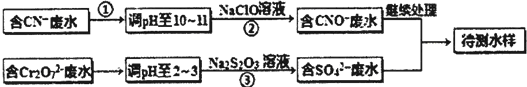
(1)流程中可用pH 试纸测定溶液的pH,pH试纸的使用方法是用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH(其他合理答案亦可);
(2)步骤②中反应无气体放出,该反应的离子方程式为CN-+ClO-═CNO-+Cl-;
(3)步骤③中,每处理1.0molCr2O7-时转移电子数为6NA,该反应的离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)取少量待测水样于试管中,加入NaOH 溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,产生该现象对应的离子方程式为Cu2++2OH=Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq).
(5)含氰化物的废水必须经检测达标后(排放标准为CN-的含量<0.5mg/L)才能排放.现取该法处理后的废水100.0mL,用“试银灵”为指示剂、1.0×10-4mol/L的AgNO3标准溶液滴定,终点时溶液由黄色变为橙红色,消耗标准液的体积为5.00mL,反应的离子方程式为Ag+2CN-=[Ag(CN)2]-,该水样中CN-的含量为0.26mg/L(不考虑Cr等元素的干扰).该厂处理后的废水能否合法排放能.
分析 (1)用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在试纸的中央,变色后与标准比色卡对照;
(2)步骤②中,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,结合电荷守恒和原子守恒书写离子方程式;
(3)1.0molCr2O7-时转移电子数为6NA,则Cr元素再还原产物中化合价为+3,即还原得到Cr3+,S2O32-被氧化为SO42-,配平书写离子方程式;
(4)铜离子与氢氧根离子反应生成Cu(OH)2蓝色沉淀,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,说明生成CuS,CuS比Cu(OH)2更难溶,符合复分解反应发生条件;
(5)根据方程式计算CN-的物质的量浓度,进而计算CN-的含量,判断废水是否合格.
解答 解:(1)用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH,
故答案为:用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH;
(2)步骤②中,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,结合电荷守恒和原子守恒,配平后离子方程式为:CN-+ClO-═CNO-+Cl-,
故答案为:CN-+ClO-═CNO-+Cl-;
(3)1.0molCr2O7-时转移电子数为6NA,即转移6mol的电子,设还原后Cr元素的化合价为x,则1mol×2×(6-x)=6mol,解得x=+3,即还原得到Cr3+,S2O32-被氧化为SO42-,反应离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)铜离子与氢氧根离子反应生成Cu(OH)2蓝色沉淀,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,说明生成CuS,CuS比Cu(OH)2更难溶,符合复分解反应发生条件,反应离子方程式为:Cu2++2OH-═Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),
故答案为:Cu2++2OH-═Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq);
(5)设CN-的物质的量浓度为x,由Ag+2CN-=[Ag(CN)2]-,可知:
0.1L×x=0.005L×1.0×10-4mol/L×2,
解得x=1.0×10-5mol/L
则CN-的含量为1.0×10-5mol/L×26g/mol=2.6×10-4g/L,即为0.26mg/L,小于0.5mg/L,故符合废水排放,
故答案为:0.26;能.
点评 本题考查物质分离和提纯,为高频考点,涉及物质含量测定、氧化还原反应、沉淀溶解平衡等知识,侧重考查学生分析计算能力,会运用化学知识结合生产、生活实际分析解答,题目难度中等.

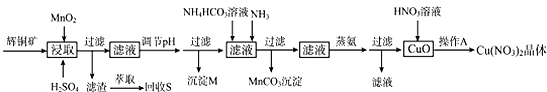
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6kg这样的辉铜矿最多能制备14.9mol无水Cu(NO3)2.(计算结果精确到小数点后1位)
| A. | 气态氢化物的稳定性:HBr>HI | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| D. | Mg、Al与同浓度盐酸反应,Mg更剧烈 |
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| Ⅰ | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| Ⅱ | 800 | c1 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
(1)在实验I中,50min时,N的浓度为0.25mol•L-1,0~50min内,以P的浓度改变表示的反应速率为0.005mol/(L.min).
(2)在实验Ⅱ中,若10~20min内,v(N)=0.10mol•L-1,则c2=0.7mol•L-1.
(3)对比两个实验,推测实验Ⅱ中M的初始浓度c1=1.0mol•L-1,反应经20minM的浓度不再变化,可推测实验Ⅱ中还隐含的条件是实验Ⅱ使用催化剂.
(4)上述实验中,反应达到限度后,M的转化率是50%.
| A. | 铁溶于稀硝酸,溶液变为浅绿色Fe+4H++NO3 --=Fe3++NO↑+2H2O | |
| B. | 向K2Cr2O7溶液中加少量浓硫酸,溶液变为黄色Cr2O7 2-(橙色)+H2O?2CrO4 2-(黄色)+2H+ | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝4H++4I-+O2=2I2+2H2O | |
| D. | 稀的氨水溶液吸收了少量的二氧化碳气体NH3•H2O+CO2=NH4++HCO3- |
