题目内容
18.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)?2NH3(g)△H=akJ•mol-1.试根据表中所列键能数据计算a的数值-93:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
已知:C(石墨,s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1①
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1②
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖斯定律,298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ•mol-1.
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态;
(2)依据△H=反应物键能和-生成物键能和求算;
(3)先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式.
解答 解:(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,
则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)△H=反应物键能和-生成物键能和=945KJ/mol+3×436KJ/mol-6×391KJ/mol=-93KJ/mol,即a=-93,
故答案为:-93;
(3)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ•mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ•mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$得到,
所以反应焓变△H=2×(-393.5kJ•mol-1)+(-571.6kJ•mol-1)×$\frac{1}{2}$-(-2599kJ•mol-1)×$\frac{1}{2}$=+226.7kJ•mol-1,298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ•mol-1;
故答案为:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ•mol-1;
点评 本题考查了热化学方程式书写和反应热的计算,明确热化学方程式书写方法及盖斯定律计算反应热的方法是解题关键,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案 拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下图.下列对该化合物叙述不正确的是( )
拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下图.下列对该化合物叙述不正确的是( )| A. | 属于芳香族化合物 | B. | 属于卤代烃 | ||
| C. | 含有官能团酯基 | D. | 在一定条件下可以发生加成反应 |
| A. | 易溶于水 | B. | 有较高的熔点 | C. | 熔化时能导电 | D. | 水溶液能导电 |
| A. | 烷烃分子中,所有的化学键都是单键 | |
| B. | 烷烃在光照条件下都能与氯气发生取代反应 | |
| C. | 烷烃的分子通式为CnH2n+2,符合通式的烃不一定是烷烃 | |
| D. | 随着碳原子数的增加,烷烃的熔沸点逐渐升高 |
①锌粒
②锌片
③锌粉
④5%的盐酸
⑤10%的盐酸
⑥15%的盐酸
⑦加热
⑧用冷水冷却
⑨不断振荡
⑩迅速混合后静置.
| A. | ②⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑤⑦⑨ | D. | ③⑥⑦⑨ |
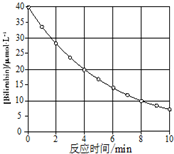 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测第16min反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测第16min反应物的浓度,结果应是( )| A. | 2.5 μmol•L-1•min-1 和2.0 μmol•L-1•min-1 | |
| B. | 2.5 μmol•L-1•min-1 和2.5 μmol•L-1•min-1 | |
| C. | 3.0 μmol•L-1•min-1 和3.0 μmol•L-1•min-1 | |
| D. | 5.0 μmol•L-1•min-1 和3.0 μmol•L-1•min-1 |
| A. | 硫铁矿燃烧前需要粉碎,因为大块的不能在空气燃烧 | |
| B. | 沸腾炉出来的炉气需净化,因为其中的SO2会与杂质反应 | |
| C. | SO2氧化为SO3时,使用催化剂可以提高硫酸的产率 | |
| D. | SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全 |
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |