题目内容
3. 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测第16min反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测第16min反应物的浓度,结果应是( )| A. | 2.5 μmol•L-1•min-1 和2.0 μmol•L-1•min-1 | |
| B. | 2.5 μmol•L-1•min-1 和2.5 μmol•L-1•min-1 | |
| C. | 3.0 μmol•L-1•min-1 和3.0 μmol•L-1•min-1 | |
| D. | 5.0 μmol•L-1•min-1 和3.0 μmol•L-1•min-1 |
分析 根据v=$\frac{△c}{△t}$计算反应4~8min间的平均反应速率;
0~4 min期间,反应物浓度变化为(40-20)μmol/L=20μmol/L,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,可知,每隔4分钟,速率降为原来的一半.据此计算.
解答 解:由图可知,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,
所以4~8 min期间,反应速率为$\frac{10μmol/L}{4min}$=2.5μ mol/(L•min).
由图可知,0~4 min期间,反应物浓度变化为(40-20)μmol/L=20μmol/L,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,可知,每隔4分钟,浓度变化量降为原来的一半.
所以8~12min浓度变化为5μ mol/L,12~16min浓度变化为2.5μ mol/L.
所以16min时浓度为10μ mol/L-5μ mol/L-2.5μ mol/L=2.5μ mol/L.
故选:B.
点评 考查反应速率的有关计算,难度中等,根据图中浓度变化判断相同时间内的浓度变化量是解题关键.

练习册系列答案
相关题目
14.同分异构体具有( )
①相同的相对分子质量
②相同的分子式
③相同的最简式
④相同的物理性质
⑤相同的化学性质.
①相同的相对分子质量
②相同的分子式
③相同的最简式
④相同的物理性质
⑤相同的化学性质.
| A. | ②③⑤ | B. | ②④ | C. | ②④⑤ | D. | ①②③ |
11.有A、B、C、D四种金属,做如下实验:①将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;②将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈;③将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | A>B>C>D | B. | C>D>A>B | C. | D>A>B>C | D. | A>B>D>C |
18.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)?2NH3(g)△H=akJ•mol-1.试根据表中所列键能数据计算a的数值-93:
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(石墨,s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1①
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1②
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖斯定律,298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ•mol-1.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)?2NH3(g)△H=akJ•mol-1.试根据表中所列键能数据计算a的数值-93:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
已知:C(石墨,s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1①
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1②
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖斯定律,298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ•mol-1.
15.香柠檬油可用于化妆品.香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图.下列说法正确的是( )


| A. | 香柠檬醚分子式为C13H9O4 | |
| B. | 香柠檬醚最多可与7 mol H2发生加成反应 | |
| C. | 1 mol香柠檬酚最多可与2 mol Br2发生反应 | |
| D. | 1 mol香柠檬酚与NaOH溶液反应,最多消耗3 mol NaOH |
9.硫酸工业生产应考虑综合经济效益问题,根据下面工业生产硫酸的工艺流程图回答有关问题: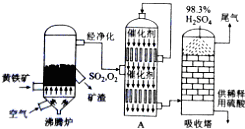
(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为4CuFeS2+13O2$\frac{\underline{\;煅烧\;}}{\;}$ 4CuO+2Fe2O3+8SO2.
(2)流程图中设备A是接触室(填设备名称),其中该设备上部迅婚使用的气体为SO2和O2.
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是可以防止形成酸雾,使三氧化硫吸收完全.
(4)根据工艺流程图及环保角度判断下列说法正确的是ABDE(填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
请用平衡移动原理解释上表中CuSO4的质量分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为12.00%.

(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为4CuFeS2+13O2$\frac{\underline{\;煅烧\;}}{\;}$ 4CuO+2Fe2O3+8SO2.
(2)流程图中设备A是接触室(填设备名称),其中该设备上部迅婚使用的气体为SO2和O2.
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是可以防止形成酸雾,使三氧化硫吸收完全.
(4)根据工艺流程图及环保角度判断下列说法正确的是ABDE(填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为12.00%.
 C8H18;
C8H18;  C6H12;
C6H12; C5H10Br2;
C5H10Br2;  C9H8O2.
C9H8O2.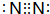 .
.
 $→_{Zn/H_{2}O}^{O_{3}}$
$→_{Zn/H_{2}O}^{O_{3}}$ +
+
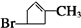 、E
、E .
.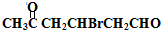 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$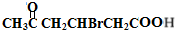 +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
.