题目内容
4.在硫酸的工业制法中,下列生产操作及对采取此操作的主要原因的叙述都正确的是( )| A. | 硫铁矿燃烧前需要粉碎,因为大块的不能在空气燃烧 | |
| B. | 沸腾炉出来的炉气需净化,因为其中的SO2会与杂质反应 | |
| C. | SO2氧化为SO3时,使用催化剂可以提高硫酸的产率 | |
| D. | SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全 |
分析 根据工业上接触法制硫酸的原料、过程,制硫酸原料为硫铁矿,进样前首先将硫铁矿粉碎,增大接触面积;生产分三步,二氧化硫的制取和净化、二氧化硫转化为三氧化硫、三氧化硫的吸收,分别在沸腾炉、接触室、吸收塔中进行;其中从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,在接触室中的催化剂可以加快反应的速率,但不会影响平衡的移动,二氧化硫的转化率不会改变;在吸收塔中生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全等来解题.
解答 解:A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中充分燃烧,硫铁矿粉碎后与氧气的接触面积增大,利于其充分的燃烧,大块的硫铁矿在空气中也能燃烧,只是燃烧不充分,会造成资源的浪费,故A错误;
B.从沸腾炉出来的炉气需净化是因为其中带有的杂质气体会让下一步接触室里面的催化剂中毒,催化剂中毒会影响反应的进度,故B错误;
C.一般来说,催化剂是指参与化学反应中间历程的,又能选择性地改变化学反应速率,而其本身的数量和化学性质在反应前后基本保持不变的物质.通常把催化剂可以加速化学反应,使反应尽快达到平衡状态,但不影响化学平衡,故二氧化硫的转化率不会改变,只是达到平衡的时间减短了,故C错误;
D.生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全,故D正确;
故选D.
点评 本题考查了工业上接触法制硫酸的原料、过程,明确发生的化学反应及设备、原料、在生产实践中采用98.3%的浓硫酸吸收的原因是解答本题的关键,并注意理论与实际生产中的差别来解答.

练习册系列答案
相关题目
17.12.8gCu与足量浓硝酸反应,铜完全反应后,如果NO3-减少0.22mol,则消耗硝酸的物质的量为( )
| A. | 0.22mol | B. | 0.40mol | C. | 0.42mol | D. | 0.62mol |
18.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)?2NH3(g)△H=akJ•mol-1.试根据表中所列键能数据计算a的数值-93:
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(石墨,s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1①
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1②
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖斯定律,298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ•mol-1.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)?2NH3(g)△H=akJ•mol-1.试根据表中所列键能数据计算a的数值-93:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
已知:C(石墨,s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1①
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1②
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖斯定律,298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ•mol-1.
15.香柠檬油可用于化妆品.香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图.下列说法正确的是( )


| A. | 香柠檬醚分子式为C13H9O4 | |
| B. | 香柠檬醚最多可与7 mol H2发生加成反应 | |
| C. | 1 mol香柠檬酚最多可与2 mol Br2发生反应 | |
| D. | 1 mol香柠檬酚与NaOH溶液反应,最多消耗3 mol NaOH |
2.镁铝合金(Mg17Al12)是一种潜在的储氢材料,该合金在一定条件下完全吸氢的化学方程式为Mg17Al12+17H2═12Al+17MgH2.得到的混合物G(12Al+17MgH2).0.1molG和足量的稀盐酸反应放出的H2与O2在KOH溶液中构成燃料电池,理论上正极上消耗氧气体积(标准状况)为( )
| A. | 44.80L | B. | 58.24L | C. | 80.64L | D. | 116.48L |
9.硫酸工业生产应考虑综合经济效益问题,根据下面工业生产硫酸的工艺流程图回答有关问题: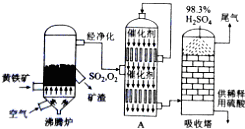
(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为4CuFeS2+13O2$\frac{\underline{\;煅烧\;}}{\;}$ 4CuO+2Fe2O3+8SO2.
(2)流程图中设备A是接触室(填设备名称),其中该设备上部迅婚使用的气体为SO2和O2.
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是可以防止形成酸雾,使三氧化硫吸收完全.
(4)根据工艺流程图及环保角度判断下列说法正确的是ABDE(填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
请用平衡移动原理解释上表中CuSO4的质量分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为12.00%.

(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为4CuFeS2+13O2$\frac{\underline{\;煅烧\;}}{\;}$ 4CuO+2Fe2O3+8SO2.
(2)流程图中设备A是接触室(填设备名称),其中该设备上部迅婚使用的气体为SO2和O2.
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是可以防止形成酸雾,使三氧化硫吸收完全.
(4)根据工艺流程图及环保角度判断下列说法正确的是ABDE(填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为12.00%.
16.下列应用中涉及氧化反应的是( )
| A. | 用明矾净化水 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 用装有硅胶的透气小袋防潮 | |
| D. | 屠呦呦用乙醚从中药中萃取青蒿素 |
13.a、b、c、d均为短周期元素,它们原子的最外层电子数分别为1、3、6、7.a、d的简单离子的电子层结构相同,b、c原子的次外层电子数均为8.下列说法正确的是( )
| A. | 单质的沸点:a>d>c | |
| B. | 简单离子的半径:c>d>a>b | |
| C. | a、b、c简单离子都会破坏水的电离平衡 | |
| D. | a、b、d的最高价氧化物对应的水化合物两两皆能反应 |
14.废弃物资源化对于建设资源节约型社会具有重要的意义.研究小组测某矿灰的成分,其主要成分为Fe,可能还含有KCl、FeO、Fe2O3、MgO、SiO2、MnO2中的若干种.为了确认其成分,某同学依次进行了以下实验:
①将过量的稀盐酸加入矿灰中,充分反应后过滤得到溶液甲和固体乙
②取少量溶液甲滴加AgNO3溶液,生成白色沉淀
③取少量溶液甲分成两等份,向其中一份滴加酸性高锰酸钾溶液,高锰酸钾溶液褪色;向另一份滴加KSCN溶液,溶液变成血红色
④取少量溶液甲加入过量NaOH溶液,并置于空气中.充分反应后经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁
根据以上实验现象或数据,该同学得出的结论正确的是( )
①将过量的稀盐酸加入矿灰中,充分反应后过滤得到溶液甲和固体乙
②取少量溶液甲滴加AgNO3溶液,生成白色沉淀
③取少量溶液甲分成两等份,向其中一份滴加酸性高锰酸钾溶液,高锰酸钾溶液褪色;向另一份滴加KSCN溶液,溶液变成血红色
④取少量溶液甲加入过量NaOH溶液,并置于空气中.充分反应后经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁
根据以上实验现象或数据,该同学得出的结论正确的是( )
| A. | 根据①可推出矿灰中一定含有SiO2 | |
| B. | 根据②可推出矿灰中一定含有KCl | |
| C. | 根据③可推出矿灰中一定含有FeO和Fe2O3 | |
| D. | 根据④可推出固体丙中一定不含MgO |