题目内容
10.甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )△H=+206.0kJ•mol-1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=-129.0kJ•mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ•mol-1.
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.
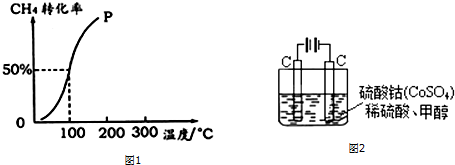
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.003mol•L-1•min-1.
②100℃时反应I的平衡常数为2.25×10-4.
(3)在压强为0.1MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,其他条件不变,对平衡体系产生的影响是C、D (填字母序号).
A.c ( H2 )减少B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加D.重新平衡c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图2装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③若右图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池负极的电极反应式:CH3OH-6e-+8OH-=CO32-+6H2O,净化含1mol甲醇的水燃料电池需消耗KOH2mol.
分析 (1)I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )△H=+206.0kJ•mol-1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=-129.0kJ•mol-1,
Ⅰ-Ⅱ得:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H,依据盖斯定律计算反应热;
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量;
①根据c=$\frac{\frac{△n}{V}}{△t}$计算v(H2);
②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;
(3)其他条件不变,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
③依据燃料电池中燃料在负极失电子发生氧化反应,结合电荷守恒配平书写电极反应,依据化学方程式计算消耗氢氧化钾物质的量.
解答 解:(1)I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )△H1=+206.0kJ•mol-1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H2=-129.0kJ•mol-1,
Ⅰ-Ⅱ得:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H,依据盖斯定律::△H=+206.0kJ/mol-(-129.0kJ/mol)=+77.0 kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77.0 kJ•mol-1;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=$\frac{\frac{1.5mol}{100L}}{5min}$=0.003 mol•L-1•min-1,
故答案为:0.003 mol•L-1•min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数K=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案为:2.25×10-4;
(3)A.平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡$\frac{c(H{\;}_{2})}{c(C{H}_{3}OH)}$减小,故D正确;
E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误;
故答案为:CD;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+;
③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,甲醇在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,则电池负极的电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,依据化学方程式计算分析2CH3OH+3O2+4KOH→2K2CO3+6H2O,净化含1mol甲醇的水燃料电池需消耗KOH物质的量2mol;
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;2.
点评 本题考查热化学方程式书写、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池等,掌握基础是解本题的关键,题目难度中等.

| A. | 过氧化氢的电子式: | B. | S2-的结构示意图: | ||
| C. | 氟化钙的电子式: | D. | CO2分子的结构式:O=C=O |
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)?2NH3(g)△H=akJ•mol-1.试根据表中所列键能数据计算a的数值-93:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
已知:C(石墨,s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1①
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1②
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1③
根据盖斯定律,298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ•mol-1.

| A. | 若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则Y极上有气泡放出 | |
| B. | 若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则溶液中Cu2+向Y极移动 | |
| C. | 若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则溶液中Cu2+向Y极移动 | |
| D. | 若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则 Y极上有黄绿色气体生成 |

| A. | 香柠檬醚分子式为C13H9O4 | |
| B. | 香柠檬醚最多可与7 mol H2发生加成反应 | |
| C. | 1 mol香柠檬酚最多可与2 mol Br2发生反应 | |
| D. | 1 mol香柠檬酚与NaOH溶液反应,最多消耗3 mol NaOH |
| A. | 44.80L | B. | 58.24L | C. | 80.64L | D. | 116.48L |
| A. | 用明矾净化水 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 用装有硅胶的透气小袋防潮 | |
| D. | 屠呦呦用乙醚从中药中萃取青蒿素 |
| A. | 熔点:金刚石>干冰 | B. | 稳定性:SiH4>H2S | ||
| C. | 碱性:KOH>Al(OH)3 | D. | 离子半径:O2->Na+ |