��Ŀ����
5����Al�Ͳ�ͬ��ͭ����Һ��ķ�ӦΪʵ�����̽��Al�벻ͬͭ����Һ��Ӧ�Ķ����ԣ�| ʵ�� | ���Թ��м���2ml��Һ | ʵ������ |
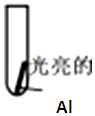 | ʵ���0.5mol/LCuCl2��Һ | 15s�������������к�ɫ�������� 60s����Ӧ��һ���ӿ��ҷ�Ӧ���ҷ��ȣ�Һ�弸������ 120s����Ƭ��Ӧ�꣬�Թ��������������ɵĺ�ɫ���� |
| ʵ���0.5mol/LCuSO4��Һ | 15s ���������� 60s����Ƭ�����м������� 120s�������������������Ƭ��Ե�к��ٺ�ɫ�������� |
��ʵ��������ɺ�ɫ���ʵ����ӷ���ʽΪ��2Al+3Cu2+=2Al3++3Cu
�ھ�����ʵ����в���������Ϊ�����������ӷ���ʽ������Һ�д���H+��ԭ��Cu2++2H2O?Cu��OH��2+2H+
����д��60s��Ӧ��һ���ӿ���ܵ�ԭ��д��������Cu��Al�������������γ�ԭ��أ���Ӧ���ȣ��¶��������ʼӿ�
��2����ʵ�������о�
ʵ���Ӧ���Ա�ʵ�������˵��Al�벻ͬ��ͭ����Һ��Ӧ���ֶ����ԣ���ԭ������У�
����һ��SO42-��Al��Cu2+���û���Ӧ����һ�����������ã�
�������Cl-��Al��Cu2+���û���Ӧ���ڴٽ�����
��3��Ϊ��һ���о��������裬�������ʵ�飺
| ʵ�� | ���Թ��м���2mL��Һ | ʵ������ |
 | ʵ���0.5mol/LCuCl2��Һ+1g Na2SO4���� | ���� Na2SO4��������ʼ������䣬���д������ݲ�������ɫ���������Ҿ��ҷ��ȣ���Ƭ��Ӧ��ȫ����Һ���� |
| ʵ�����0.5mol/L CuCl2��Һ+5g Na2SO4���� | ����Na2SO4��������ʼ������䣬���д������ݲ�������ɫ���������Ҿ��ҷ��ȣ���Ƭ��Ӧ��ȫ����Һ���� | |
| ʵ�����0.5mol/LCuSO4��Һ+0.02mol NaCl���� | δ���� NaCl����ǰ����û���������Ƭ����Ѹ�ٲ�����������ͺ�ɫ���ʣ���Һ�¶����������ڣ�����Ӧ��ȫ | |
| ʵ�����0.5mol/LCuSO4��Һ+0.02mol NH4Cl���� | δ���� NH4Cl����ǰ����û���������Ƭ����Ѹ�ٲ�����������ͺ�ɫ���ʣ���Һ�¶����������ڣ�����Ӧ��ȫ |
���У�ʵ�����ʵ������Աȣ�����Ϊ��SO42-��Al��Cu2+���û���Ӧû����������
���У�ʵ�����ʵ����������Աȣ�����Ϊ��Cl-��Al��Cu2+���û���Ӧ���ڴٽ�����
��4�������ʵ��֤��Cl-��Al��H+�ķ�Ӧͬ�������Ƶ����ã���ɰֽ��ĥ�����Ƭ�ֱ���H+Ũ�Ⱦ�Ϊ0.2mol/L����������ᷴӦ��ǰ�߸����ң�
���� ��1������Al�Ͳ�ͬ��ͭ����Һ��ķ�ӦΪʵ�����ʵ���0.5mol/LCuCl2��Һ�������������к�ɫ�������������û�ͭ���ɵ�ͭ���ʣ�
�ھ�����ʵ����в���������Ϊ���������ý�����Ӧ���ɣ�˵����Һ�д��������ӣ���ͭ����ˮ��Ľ����
��60s����Ӧ��һ���ӿ��ҷ�Ӧ���ҷ��ȣ�Һ�弸�����ڣ�˵����Ӧ�Ƿ��ȷ�Ӧ���û�����ͭ�����ڵ������Һ������ԭ��ط�Ӧ��
��2��ʵ���Ӧ���Ա�ʵ�������˵��Al�벻ͬ��ͭ����Һ��Ӧ���ֶ����ԣ�ʵ���0.5mol/LCuCl2��Һ��ʵ���0.5mol/LCuSO4��Һ������Ӧ�����Ӻ���������ӶԷ�ӦӰ�죻
��3��̽������һ��SO42-��Al��Cu2+���û���Ӧ����һ�����������ã��������Cl-��Al��Cu2+���û���Ӧ���ڴٽ����ã��Ա�ʵ����Ҫ�����Ȼ�狀��Ȼ������ʵ�����ͬ��
��4�������ʵ��֤��Cl-��Al��H+�ķ�Ӧͬ�������Ƶ����ÿ���������������Ũ����ͬ�����������Ա�ʵ����֤������Ӱ���
��� �⣺��1����ʵ���0.5mol/LCuCl2��Һ�������������к�ɫ�������������û�ͭ���ɵ�ͭ���ʣ���Ӧ�����ӷ���ʽΪ��2Al+3Cu2+=2Al3++3Cu��
�ʴ�Ϊ��2Al+3Cu2+=2Al3++3Cu��
�ھ�����ʵ����в���������Ϊ�����������ӷ���ʽ������Һ�д���H+��ԭ����ͭ����ˮ��Ľ����Cu2++2H2O?Cu��OH��2+2H+��
�ʴ�Ϊ��Cu2++2H2O?Cu��OH��2+2H+��
��60s����Ӧ��һ���ӿ��ҷ�Ӧ���ҷ��ȣ�Һ�弸�����ڣ�˵����Ӧ�Ƿ��ȷ�Ӧ���¶��������ʼӿ죬�û�����ͭ�����ڵ������Һ������ԭ��ط�Ӧ�ӿ췴Ӧ���ʣ�
�ʴ�Ϊ��Cu��Al�������������γ�ԭ��أ���Ӧ���ȣ��¶��������ʼӿ죻
��2��ʵ���Ӧ���Ա�ʵ�������˵��Al�벻ͬ��ͭ����Һ��Ӧ���ֶ����ԣ�ʵ���0.5mol/LCuCl2��Һ��ʵ���0.5mol/LCuSO4��Һ������Ӧ�����Ӻ���������ӶԷ�ӦӰ�죬����һ��SO42-��Al��Cu2+���û���Ӧ����һ�����������ã��������Cl-��Al��Cu2+���û���Ӧ���ڴٽ����ã�
�ʴ�Ϊ��Cl-��Al��Cu2+���û���Ӧ���ڴٽ����ã�
��3��̽������һ��SO42-��Al��Cu2+���û���Ӧ����һ�����������ã��������Cl-��Al��Cu2+���û���Ӧ���ڴٽ����ã��Ա�ʵ����Ҫ�����Ȼ�狀��Ȼ������ʵ�����ͬ��ʵ�����0.5mol/LCuSO4��Һ����0.02molNH4Cl���壬δ���� NH4Cl����ǰ����û���������Ƭ����Ѹ�ٲ�����������ͺ�ɫ���ʣ���Һ�¶����������ڣ�����Ӧ��ȫ�����Ŀ���Ƕ���ʵ�飬�ų�Na+�ĸ��ţ�֤��Na+�Ը÷�Ӧ�����Ӱ�죬���У�ʵ�����ʵ������Աȣ�����Ϊ��SO42-��Al��Cu2+���û���Ӧû���������ã����У�ʵ�����ʵ����������Աȣ�����Ϊ��Cl-��Al��Cu2+���û���Ӧ���ڴٽ����ã�
�ʴ�Ϊ��0.02mol�� ����ʵ�飬�ų�Na+�ĸ��ţ�֤��Na+�Ը÷�Ӧ�����Ӱ�죻SO42-��Al��Cu2+���û���Ӧû���������ã�Cl-��Al��Cu2+���û���Ӧ���ڴٽ����ã�
��4�������ʵ��֤��Cl-��Al��H+�ķ�Ӧͬ�������Ƶ����ã���������������Ũ����ͬ����������ᣬ��ɰֽ��ĥ�����Ƭ�ֱ���H+Ũ�Ⱦ�Ϊ0.2mol/L����������ᷴӦ��ǰ�߸����ң�
�ʴ�Ϊ����ɰֽ��ĥ�����Ƭ�ֱ���H+Ũ�Ⱦ�Ϊ0.2mol/L����������ᷴӦ��ǰ�߸����ң�
���� ���⿼�����������ʵ�ʵ����֤���Ա�����ķ����жϡ����̷��������������Ӧ���ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�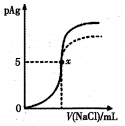 ��֪��pAg=-lg[c��Ag+��]��Ksp��AgCl��=1��l0-10��Ksp��AgI��=l��l0-17����ͼ����l0mLAgNO3��Һ�м���0��lmol/LNaCI��Һʱ����Һ��pAg���ż���NaCl��Һ������仯��ͼ��ʵ�ߣ�������ͼ���������н�����ȷ���ǣ�������
��֪��pAg=-lg[c��Ag+��]��Ksp��AgCl��=1��l0-10��Ksp��AgI��=l��l0-17����ͼ����l0mLAgNO3��Һ�м���0��lmol/LNaCI��Һʱ����Һ��pAg���ż���NaCl��Һ������仯��ͼ��ʵ�ߣ�������ͼ���������н�����ȷ���ǣ�������| A�� | ԭAgNO3��Һ�����ʵ���Ũ��Ϊ0��l mol/L | |
| B�� | ͼ��x���ʾ��Һ��c��Ag+��=c��Cl-�� | |
| C�� | ͼ��x�������Ϊ��10��5�� | |
| D�� | ��NaCl��Һ����0.1 mol/L��MaCl��Һ����ͼ�����յ���Ϊ���߲��� |
| A�� | ԭ�Ӱ뾶��A��B��C | |
| B�� | ����Ԫ�ص�����������Ӧˮ��������ɻ��Ϸ�Ӧ�õ� | |
| C�� | A���⻯���ȶ���С��C���⻯���ȶ��� | |
| D�� | B ��A�����������ɷ����û���Ӧ |
| A�� | ��ɱ������� | B�� | �����������ʯ�ҵ��ۻ� | ||
| C�� | �Ȼ��ƺ������ۻ� | D�� | ���ʯ���ۻ��ͱ����ڻ� |
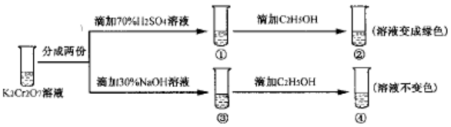
| A�� | ������Һ��ƣ�������Һ��ɫ���� | |
| B�� | �������淴Ӧ��ƽ�ⳣ�����٣��� | |
| C�� | K2Cr2O7��Һ�������������������¸�ǿ | |
| D�� | ������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ |
| A�� | �����������Ҵ��ķ�����÷�Һ���� | |
| B�� | �ζ��ܡ�����ƿ����Һ©������������ʹ��ǰ��������������Ƿ�©ˮ | |
| C�� | ����м�CCl4�����ú��ϲ㼸��Ϊ��ɫ���²�Ϊ��ɫ | |
| D�� | ������������������ʷе㲻ͬ�������ʷ���ķ��� |
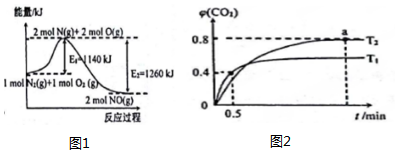
��ҵ������úת��ΪCO��������CO��ˮ������Ӧ��H2ʱ����������ƽ�⣺CO��g��+H2O��g��?CO2��g��+H2��g��
��1����1L�����ܱ������г���CO��H2O��g����800��ʱ��ò����������±���
| t/min | 0 | 1 | 2 | 3 | 4 |
| n��H2O��/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n��CO��/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
��2����ͬ�����£���2L�����ܱ������г���1molCO��1mol H2O��g����2molCO2��2mo1H2��
��ʱ���������� �����棩���������=����������
��3��һ���¶��£��ں����ܱ�������NO2��O2��Ӧ���£�4NO2��g��+O2��g��?2N2O5��g��������֪K350�棼K300�棬��÷�Ӧ�Ƿ��ȷ�Ӧ������ȡ����ȡ�����
����֪CO��g����H2��g����CH3OH��l����ȼ���ȷֱ�Ϊ283kJ•mol-1��286kJ•mol-1��726kJ•mol-1
��4������CO��H2�ϳ�Һ̬�״����Ȼ�ѧ����ʽΪCO��g��+2H2��g��=CH3OH��l����H=-129kJ•mol-1��
��5�����ݻ�ѧ��Ӧԭ������������ѹǿ���Ʊ��״���Ӧ��Ӱ������ѹǿʹ��Ӧ���ʼӿ죬ͬʱƽ�����ƣ�CH3OH��������
��Ϊ���Ѷ�ʯ�͵Ĺ���������������Ա��úҺ���Ʊ����ͣ������������ȼ�ϵ�أ���ع���ԭ����ͼ��ʾ��

һ���缫ͨ����������һ�缫ͨ������������������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O${\;}_{2}^{-}$
��6�������飨C8H18���������ͣ�д���õ�ع���ʱ�ĸ�����Ӧ����ʽC8H18-50e-+25O2-=8CO2+9H2O��
��7����֪һ�����ӵĵ�����1.602��10-19C���øõ�ص�ⱥ��ʳ��ˮ������·��ͨ��1.929��105C�ĵ���ʱ������NaOH80g��
����úȼ�ղ�����CO2���������ЧӦ����Ҫ����֮һ��
��8����CO2ת�����л������Ч��ʵ��̼ѭ�����磺
a��6CO2+6H2O$\stackrel{����/Ҷ����}{��}$C6H12O6+6O2
b��2CO2+6H2$��_{��}^{����}$C2H5OH+3H2O
c��CO2+CH4$��_{��}^{����}$ CH3COOH
d��2CO2+6H2$��_{��}^{����}$CH2=CH2+4H2O
���Ϸ�Ӧ�У�����ܵ��ǣ���Ӧc��������ԭ��������Ϊ100%��