题目内容
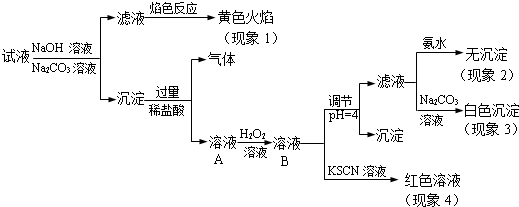
10.电解精炼铜的阳极泥中含有多种贵重金属,从中提取金、银、铂的一种工艺如下:
(1)王水是浓盐酸和浓硝酸的混合液,其体积比为3:1.
(2)滤渣的成分是AgCl,反应Ⅰ中肼(N2H4)的作用是做还原剂.
(3)反应Ⅱ的离子方程式为2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+;当生成19.7gAu时,25℃和101kPa下反应消耗3.675L SO2(此条件下的气体摩尔体积为24.5L/mol,相对原子质量Au:197).
(4)电解法精炼银时,粗银应与直流电源的正极(填“正”或“负”)相连,当用AgNO3 和HNO3 混合溶液做电解质溶液时,发现阴极有少量红棕色气体,则产生该现象的电极反应式为2H++NO3-+e-=NO2↑+H2O.
(5)完成下面化学反应方程式:
3(NH4)2PtCl6$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+3Pt+16HCl↑+2NH4Cl
(6)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,原因是王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水.
分析 粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银、铂作为阳极泥而沉淀下来,王水溶解后得到金铂的溶液和AgCl沉淀,过滤后的氯化银滤渣用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银,滤液中通入二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,过滤得到滤液中 含PtCl62-,加入固体氯化铵得到沉淀(NH4)2PtCl6,受热分解得到金属Pt,
(1)根据王水的组成分析判断;
(2)王水溶解后得到金铂的溶液和AgCl沉淀,过滤后的氯化银滤渣用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银;
(3)银镜流程变化故选结合反应物和生成物的离子和物质,分析化合价变化,银镜氧化还原反应的电子守恒计算分析书写,依据化学方程式电离关系计算标准状况下生成的二氧化硫气体;
(4)电解法精炼银时粗银做电解池阳极,精银做电解池阴极,含银离子的盐溶液做电解质溶液,依据粗银提纯的原理分析判断电极,当用AgNO3和HNO3混合溶液做电解质溶液时,发现阴极有少量红棕色气体,是硝酸根离子失电子发生还原反应,结合电极反应书写方法写出;
(5)(NH4)2PtCl6受热分解得到金属Pt,其中元素化合价变化的是铂元素化合价降低,需要元素化合价升高的应是氮元素,-3价变化为0价;
(6)依据王水组成,结合平衡移动方向分析判断.
解答 解:(1)王水的组成是浓盐酸和浓硝酸按照3:1混合组成的混合物,故答案为:浓盐酸和浓硝酸,3:1;
(2)粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银、铂作为阳极泥而沉淀下来,王水溶解后得到金铂的溶液和AgCl沉淀,过滤后的氯化银滤渣用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银,
故答案为:AgCl,做还原剂;
(3)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,依据氧化还原反应的电子守恒分析计算写出离子方程式为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+,当生成19.7gAu时物质的量=$\frac{19.7g}{197g/mol}$=0.1mol,
3SO2~2Au
3 2
n 0.1mol
n=0.15mol
此条件下的气体摩尔体积为24.5L/mol,25℃和101kPa下反应消耗二氧化硫气体体积=24.5L/mol×0.15mol=3.675g,
故答案为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+,3.675;
(4)电解法精炼银时,粗银做阳极与电源正极相连,精银做阴极,含银离子的硝酸银做电解质溶液,当用AgNO3和HNO3混合溶液做电解质溶液时,发现阴极有少量红棕色气体二氧化氮生成,电极反应是在阴极上硝酸根离子被还原生成二氧化氮,电极反应为NO3-+2H++e-=NO2↑+H2O,
故答案为:正;NO3-+2H++e-=NO2↑+H2O;
(5)(NH4)2PtCl6受热分解得到金属Pt,其中元素化合价变化的是铂元素化合价降低,需要元素化合价升高的应是氮元素,-3价变化为0价,结合电子守恒和原子守恒配平得到化学方程式为:3(NH4)2PtCl6 $\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+3Pt+16HCl↑+2NH4Cl,
故答案为:3,2N2,3,16,2;
(6)金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水,
故答案为:王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水.
点评 本题考查了金属精炼原理的应用,银氨溶液和含醛基的反应离子方程式的书写,氧化还原反应的分析判断,平衡移动的影响因素分析,题目难度中等.

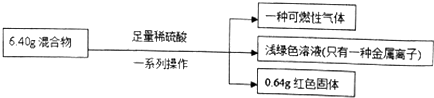
根据实验所得数据,下列说法不正确的是( )
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1 mol任何物质都含有6.02×1023个原子 | |
| B. | 标准状况下,22.4L NH3的物质的量为1mol | |
| C. | 硫酸的摩尔质量是98 g | |
| D. | 常温常压下,1 mol氧气的体积为22.4 L |
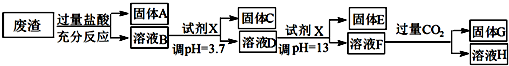
已知常温条件下:
①阳离子以氢氧化物形式完全沉淀(阳离子浓度低于10?5mol•L-1)时溶液的pH:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 11 |
请回答:
(1)写出A与氢氟酸反应的化学方程式:SiO2+4HF=SiF4↑+2H2O.
(2)上述流程中两次使用试剂X,推测试剂X是氢氧化钠(填“氨水”或“氢氧化钠”)其理由是经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性.
(3)写出F→H的反应离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全.
(5)固体C跟HI反应的离子方程式为:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O.
(6)试计算Mg(OH)2的Ksp=10-11.
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn.
(2)现代冶炼金属锰的一种工艺流程如下图所示:

下表为t℃时,有关物质的pKsp(注:pKsp=-lgKsp).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
①该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度.
②滤液1的pH>(填“大于”、“小于”或“等于”)MnSO4浸出液的pH.
③加入MnF2的主要目的是除去Ca2+(填Ca2+、Fe3+或Cu2+).
(3)由MnSO4制取MnCO3:往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)═Mn(OH)2(s)+CO32-(aq),t℃时,计算该反应的平衡常数K=100(填数值).