题目内容
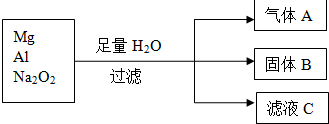
15..四个可加热的密闭容器中,分别装有;①Na2O2和NaHCO3;②Na2O2和NH4HCO3;③Na2O2和Ca(HCO3)2;④Na2CO3和NaHCO3.各容器中每种物质均为0.5mol,现将各容器加热至300℃,完全分解后排出气体,四个容器中残留固体只有Na2CO3的容器是( )| A. | ①② | B. | ②④ | C. | ②③ | D. | ①④ |
分析 加热时:①碳酸氢钠加热分解生成二氧化碳和水,与过氧化钠反应生成碳酸钠和氢氧化钠;②NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑,2CO2+2Na2O2=2Na2CO3+O2;③Ca(HCO3)2受热分解生成碳酸钙水和二氧化碳,二氧化碳与水和过氧化钠反应生成碳酸钠和氢氧化钠,④2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,以此解答该题.
解答 解:加热时:①碳酸氢钠加热分解生成二氧化碳和水,与过氧化钠反应生成碳酸钠和氢氧化钠;②NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑,2CO2+2Na2O2=2Na2CO3+O2;③Ca(HCO3)2受热分解生成碳酸钙水和二氧化碳,二氧化碳与水和过氧化钠反应生成碳酸钠和氢氧化钠,④2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,所以残留固体只有Na2CO3的容器是②④,故选B.
点评 本题综合考查元素化合物知识,侧重于学生的分析能力和计算能力的考查,注意把握物质的性质,根据反应的方程式解答该题,注意通常在定量条件下先考虑CO2和Na2O2的反应情况,难度不大.

练习册系列答案
相关题目
6.实验室中下列实验药品的保存和事故处理的方法中,不正确的是( )
| A. | 不慎把浓硫酸沾在手上,立即用干布拭去,再用水冲洗 | |
| B. | 少量金属钠应保存在煤油中 | |
| C. | 氢氟酸、浓硝酸、氯水存放在带橡皮塞的棕色玻璃瓶中 | |
| D. | 漂白粉应密封保存 |
3.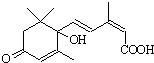 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )
 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )| A. | 其分子中含有3种官能团 | |
| B. | 能发生氧化反应,又能发生取代反应 | |
| C. | 可以与FeCl3溶液发生显色反应 | |
| D. | 1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
7.水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如下.下列说法不正确的是( )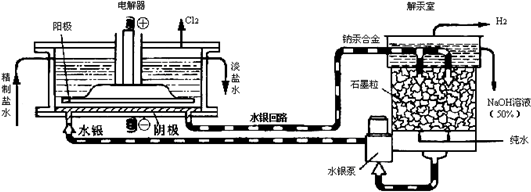

| A. | 电解器中阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 解汞室中产生氢气的电极为阴极 | |
| C. | 当阳极产生3.36 L(标准状况)气体时,解汞室中生成NaOH的质量为12 g | |
| D. | 在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开 |
5.常温下,浓度均为0.1mol•L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别缴入NaOH固体,lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
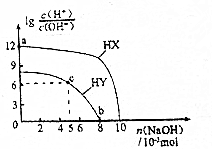

| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12mol•L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全中和 |

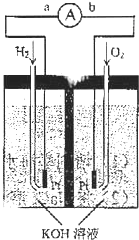 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答: