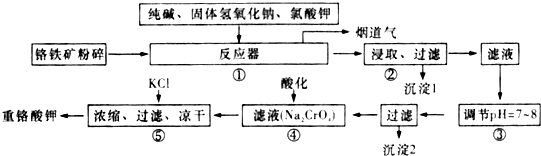
题目内容
20.称取铁粉和氧化铜的混合物6.40g,进行如下实验: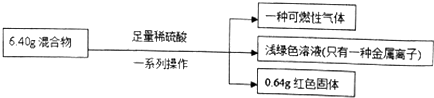
根据实验所得数据,下列说法不正确的是( )
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
分析 生成可燃性气体,说明铁粉过量,发生反应:Fe+H2SO4=FeSO4+H2↑,反应后的溶液为浅绿色,且只有一种金属离子,则发生反应CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换;根据Cu的质量计算CuO质量,进而计算Fe的质量,根据电子转移计算生成氢气的质量.
解答 解:生成可燃性气体,说明发生反应Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,
生成0.64gCu,其物质的量:$\frac{0.64g}{64g/mol}$=0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
故混合物中:m(CuO)=0.01mol×80g/mol=0.8g,则:m(Fe)=6.40g-0.8g=5.6g,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
A.根据分析可知,铜的质量为0.64g,故A正确;
B.设氢气的物质的量为nmol,根据电子转移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,没有告诉在标准状况下,不能使用标准状况下气体摩尔体积计算氢气体积,故B错误;
C.铁的物质的量为0.1mol,反应生成溶质为硫酸亚铁,则反应消耗的硫酸的物质的量为0.1mol,故C正确;
D.由上述分析可知,Fe的质量为5.6g,混合物中Fe的质量分数为:$\frac{5.6g}{6.4g}$×100%=87.5%,故D正确;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.

(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1.
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为:NaClO+2NH3=N2H4+NaCl+H2O.
(3)一定条件下,在2L密闭容器中起始投入2mol NH3和4mol O2发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0
测得平衡时数据如下:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
②温度T1和T2的大小关系是T1<T2(填“>”、“<”或“=”).
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为2CO2+4e-+2H2O=2CO+4OH-.有人提出,可以设计反应2CO═2C+O2(△H>0)来消除CO的污染.请你判断上述反应是否能自发进行并说明理由不能,因为该反应的△H>0,△S<O.
(5)图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液.
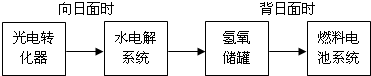
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为2mol.
①Na+、OH-、SO42-
②H+、Cl-、SO42-
③Na+、K+、OH-
④Na+、K+、NO3-.
| A. | ②③④ | B. | ②①④ | C. | ②③① | D. | ②①③ |
| A. | 乙醇和乙酸分子都能和金属钠反应 | |
| B. | 乙酸能溶于水,但不溶于乙醇 | |
| C. | 乙醇和乙酸均能使紫色石蕊试液变红 | |
| D. | 乙醇和乙酸互为同分异构体 |
| A. | NaHCO3═CO32-+H++Na+ | B. | S2-+H2O?H2S+2 OH- | ||
| C. | H3PO4?3H++PO43- | D. | NH3•H2O?NH4++OH- |