��Ŀ����
17���������ȣ�NOCl����һ�ֺ��ɫҺ����ɫ���壬���۵�-64.5�棬�е�-5.5�棬��ˮ��ˮ�⣮�����л��ϳ��е���Ҫ�Լ�������NO��Cl2�ڳ��³�ѹ�ºϳɣ���1��ʵ�����Ʊ�ԭ����NO��Cl2��װ����ͼ1��ʾ��
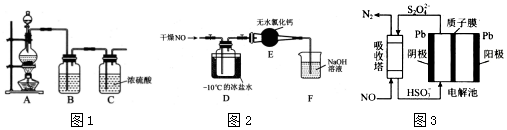
ʵ������Cl2ʱ��װ��A����ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl
 MnCl2+Cl2��+H2O��װ��B��ʢ�ŵ��Լ�Ϊ����ʳ��ˮ��������Ϊ��ȥ�����е��Ȼ������壮
MnCl2+Cl2��+H2O��װ��B��ʢ�ŵ��Լ�Ϊ����ʳ��ˮ��������Ϊ��ȥ�����е��Ȼ������壮��2���������ռ�����Cl2����D�ļ���ƿ�У���ͼ2��ʾʾװ���Ʊ��������ȣ�
��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����NOCl�ĵ���ʽΪ
 ��
����װ��D�з����ķ�Ӧ����ʽΪ2NO+Cl2=2NOCl��
���������װ��E������ʲô���F�е�ˮ��������Dװ���У��ᵼ�²�Ʒˮ�⣮
��ijͬѧ��Ϊװ��F������Ч����β���е�ij�����壬������ΪNO��Ϊ�˳������β�����ɽ�β����O2ͬʱͨ������������Һ�У�
��3����ҵ�Ͽ��ü�ӵ绯ѧ����ȥNO����ԭ����ͼ3��ʾ���������з����ķ�ӦΪ��NO+S2O42-+H2O��N2+HSO3-
���������ڷ�����Ӧ���������뻹ԭ�����ʵ���֮��Ϊ1��1��
�������ĵ缫��ӦʽΪ2HSO3-+2e-+2H+�TS2O42-+2H2O��
���� ��1��ʵ���������Ʊ�������Ũ�����MnO2��ϼ��ȣ���ϵ����غ㡢ԭ���غ�д���˷�Ӧ�Ļ�ѧ����ʽ��Ũ�����лӷ��ԣ��Ƶõ������л���HCl��Ӧͨ��B����Һ���ӣ��ݴ˷����жϣ�
��2����NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����ԭ������ԭ���γ����Թ��õ��Ӷԣ�����ԭ���γ�һ�ԣ�
��װ��D���ɻ���ɫ�����������˺��ɫҺ��NOCl�����ݷ�Ӧ��֮�䷢����������ԭ��Ӧ����ϵ����غ���д��ѧ����ʽ��
�۸���NOCl��ˮ�ֽ⣬��װ����Ӧ��ˮ������
��NO������ˮ����������һͬͨ�������������գ�
��3������������������һ����������������ԭ��Ӧ�����ɵ������ɸ������ӷ�Ӧ����ʽ������غ��ж��������뻹ԭ�������ʵ���֮�ȣ�
������������ԭ��Ӧ����������������ӣ��õ��ӣ����������������ӣ�
��� �⣨1��ʵ�������ö������̺�Ũ�����ϼ�����Cl2��������Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl  MnCl2+Cl2��+2H2O����ѡ�ö������̺�Ũ���ᣬ�Ƶõ����������Ȼ������壬�ñ���ʳ��ˮ��ȥ��
MnCl2+Cl2��+2H2O����ѡ�ö������̺�Ũ���ᣬ�Ƶõ����������Ȼ������壬�ñ���ʳ��ˮ��ȥ��
�ʴ�Ϊ��MnO2+4HCl 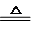 MnCl2+Cl2��+H2O������ʳ��ˮ����ȥ�����е��Ȼ������壻
MnCl2+Cl2��+H2O������ʳ��ˮ����ȥ�����е��Ȼ������壻
��2����NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����ԭ������ԭ���γ����Թ��õ��Ӷԣ�����ԭ���γ�һ�ԣ�����ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��װ��D��Ϊ�����Ʊ�NOCl��Ϊ����ɫ������dz���к��ɫҺ�����ɣ�������Ӧ�Ļ�ѧ����ʽΪ2NO+Cl2=2NOCl��
�ʴ�Ϊ��2NO+Cl2=2NOCl��
��NOCl��ˮ�ֽ⣬���û��װ��E����ˮ�Ȼ�������ˮ������F�е�ˮ�������� D װ���У��ᵼ�²�Ʒˮ�⣻
�ʴ�Ϊ��F�е�ˮ�������� D װ���У��ᵼ�²�Ʒˮ�⣻
��NO������ˮ����������һͬͨ�������������գ�����
�ʴ�Ϊ��NO��O2��
��3������������������һ����������������ԭ��Ӧ�����ɵ��������ӷ�Ӧ����ʽΪ��2NO+2S2O42-+2H2O�TN2+4HSO3-������NOΪ��������Ϊ��ԭ�������ߵ����ʵ���֮��Ϊ1��1���ʴ�Ϊ��1��1��
������������ԭ��Ӧ����������������ӣ��õ��ӣ����������������ӣ��缫��ӦʽΪ��2HSO3-+2e-+2H+�TS2O42-+2H2O��
�ʴ�Ϊ��2HSO3-+2e-+2H+�TS2O42-+2H2O��
���� ���⿼���������Ʊ�������ƣ���Ҫ�����˻�ѧ����ʽ����д��ʵ�鷽�����ۡ�������ԭ��Ӧ�����������ȣ���Ŀ�Ѷ��еȣ������ڿ���ѧ���ķ�������ͽ�������������ע����ػ���֪ʶ��ѧϰ����ۣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | �����£�5.6g������Ͷ��������Ũ�����У�����ת����Ϊ0.3NA | |
| B�� | 18g D2O������������Ϊ10NA | |
| C�� | ��״���£�8 gSO3����ԭ����Ϊ0.4NA | |
| D�� | �����£�1.0LpH=13��Ba ��OH�� 2��Һ�к��е�OH-��ĿΪ0.2NA |
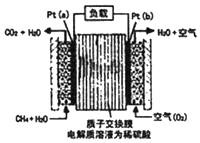 ij�ּ���ȼ�ϵ�ز��ò����缫������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ����������ṹ��ͼ������ܷ�ӦΪ��CH4+2O2�TCO2+2H2O�������й�˵����ȷ���ǣ�������
ij�ּ���ȼ�ϵ�ز��ò����缫������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ����������ṹ��ͼ������ܷ�ӦΪ��CH4+2O2�TCO2+2H2O�������й�˵����ȷ���ǣ�������| A�� | ������a������������������b�� | |
| B�� | �������Һ��H+����a�� | |
| C�� | ÿת��1mole-������1.6gCH4 | |
| D�� | b���ϵĵ缫��ӦʽΪ��O2+2H2O+4e-=4OH- |
| A�� | 8�� | B�� | 10�� | C�� | 11�� | D�� | 12�� |
| A�� | 0.1mol-NH2���������������еĵ�����Ϊ0.9NA | |
| B�� | lmol D218O������������Ϊ12NA | |
| C�� | 14 g����ϩ��۱�ϩ�Ļ�����к�Hԭ�ӵ���ĿΪ2NA | |
| D�� | һ�������£�0.2 mol SO2������O2��ַ�Ӧ�����ɵ�SO3������Ϊ0.2NA |
| A�� | ��ˮ������ | B�� | ����������Һ�ʹ��� | ||
| C�� | ���������������Һ | D�� | �����ʯ��ˮ |
| A�� | 3����Һ��pH��С���Ǣ� | |
| B�� | 3����Һ��ˮ�ĵ���̶������Ǣ� | |
| C�� | ����ڵ������Ϻ���Һ������ | |
| D�� | ����۵������Ϻ�c��H+����c��CH3COO-����c��OH-�� |