题目内容
19.硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.(1)用脱硫剂ZDE-01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3•H2O(s)+3H2S(g)=Fe2S3•H2O(s)+3H2O(g)△H=-akJ/mol
②再生:2Fe2S3•H2O(s)+3O2(g)=2Fe2O3•H2O(s)+6S(s)△H=-bkJ/mol
则2H2S(g)+O2(g)=2H2O(g)+2S(s)△H=-$\frac{(2a+b)}{3}$kJ/mol(用a、b表示)
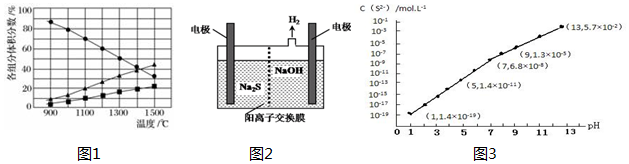
(2)H2S在高温下分解生成硫蒸气和H 2.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,
①H 2 S在高温下分解反应的化学方程式为2H2S(g)?2H2(g)+S2(g).
②据图1计算;若1400℃时,VL恒容容器中加入amol的H2S,则该条件下的平衡常数可表示为$\frac{a}{4V}$mol•L-1
(3)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图2所示的电解池的阳极区进行电解
①写出电解时阴极的电极反应式:2H2O+2e-=H2↑+2OH-.
②Na2S溶液中离子浓度由大到小顺序:c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)
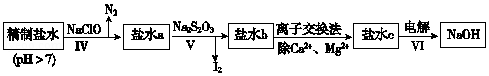
(4)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol•L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图3所示(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.
分析 (1)①将已知方程式变形:$\frac{①×2-②}{3}$得目标方程式:2H2S(g)+O2(g)=2H2O(g)+2S(s),依据盖斯定律计算反应热;
(2)①依据题干可知:H2S在高温下分解生成氢气、S,结合图中数据可知反应为可逆反应,依据原子个数、得失电子数守恒书写方程式;
②依据图表中达到平衡时各物质的百分含量,列三段计算反应平衡常数;
(3)①电解池阴极发生还原反应,图中阴极区为氢氧化钠溶液,则水电离产生的氢离子得到电子生成氢气,据此书写电极反应式;
②硫化钠为强碱弱酸盐,硫离子水解而使其溶液呈碱性,硫离子有两步水解,第一步水解能力远远大于第二步;
(4)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;
解答 解:(1)已知①脱硫:Fe2O3•H2O(s)+3H2S(g)=Fe2S3•H2O(s)+3H2O(g)△H=-akJ/mol
②再生:2Fe2S3•H2O(s)+3O2(g)=2Fe2O3•H2O(s)+6S(s)△H=-bkJ/mol
则得到2H2S(g)+O2(g)=2H2O(g)+2S(s),依据盖斯定律可知反应的焓变为:-$\frac{(2a+b)}{3}$ kJ/mol;
故答案为:-$\frac{(2a+b)}{3}$ kJ/mol;
(2)①依据题干可知:H2S在高温下分解生成氢气、S,结合图中数据可知反应为可逆反应依据原子个数、得失电子数守恒可知反应的方程式:2H2S(g)?2H2(g)+S2(g);
故答案为:2H2S(g)?2H2(g)+S2(g);
②据图1计算;若1400℃时,VL恒容容器中加入amol的H2S,达到平衡时,硫化氢、氢气体积分数为40%,S2(g)的体积分数为:20%,设生成的S2(g)物质的量为xmol,则:
2H2S(g)?2H2(g)+S2(g)
a 0 0
2x 2x x
a-2x 2x x
达到平衡时,硫化氢、氢气体积分数相等,即a-2x=2x,解得x=$\frac{a}{4}$;
则平衡时,H2S物质的量浓度为:$\frac{a}{2V}$mol/L,H2物质的量浓度为:$\frac{a}{2V}$mol/L,S2物质的量浓度为:$\frac{a}{4V}$mol/L,
则反应平衡常数为:$\frac{\frac{a}{4V}×\frac{a}{2V}×\frac{a}{2V}}{\frac{a}{2V}×\frac{a}{2V}}$=$\frac{a}{4V}$;
故答案为:$\frac{a}{4V}$;
(3)①电解池阴极发生还原反应,图中阴极区为氢氧化钠溶液,则水电离产生的氢离子得到电子生成氢气,电极反应式:2H2O+2e-=H2↑+2OH-;
故答案为:2H2O+2e-=H2↑+2OH-;
②硫化钠为强碱弱酸盐,硫离子易水解而使其溶液呈碱性,硫离子第一步水解能力远远大于第二步,溶液中氢氧根离子来源于水的电离和硫离子水解,硫氢根离子只来源于硫离子水解,但硫离子的水解能力较小,所以溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+);
故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+);
(4))①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{Ksp(MnS)}{c(M{n}^{2}{\;}^{+})}$=$\frac{2.8×10{\;}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5.
点评 本题为综合题,考查了反应热的计算、方程式的书写、化学平衡常数的计算、离子浓度大小的比较、电极反应式的书写、pH值的计算,题目综合性强,难度较大,熟悉盖斯定律计算反应热的方法、化学平衡常数的计算、电解池原理、盐类水解的规律是解题关键.

 名校课堂系列答案
名校课堂系列答案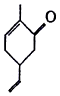
| A. | 可以发生氧化反应 | B. | 分子式为C9H10O | ||
| C. | 分子中所有原子都处于同一平面上 | D. | 能使溴的四氯化碳溶液褪色 |
| X | Y | |
| Z |
| A. | Y的单质与水反应时,Y的单质既是氧化剂又是还原剂 | |
| B. | X的最高价氧化物对应的水化物与其气态氢化物可以反应生成盐 | |
| C. | X、Y、Z元素形成的单质,常温下Z单质的沸点最底 | |
| D. | X的氢化物只有一种 |
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程Ⅰ除去的离子是SO42-,对应的离子方程式是Ba2++SO42-═BaSO4↓.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:
过程Ⅳ除去的离子是NH4+、I-.
| A. | 同分异构现象只存在于有机物和无机物之间 | |
| B. | 同分异构现象不存在于无机物之间 | |
| C. | 在无机化合物和有机化合物间一定存在同分异构现象 | |
| D. | 在无机化合物和有机化合物间可能存在同分异构现象 |
| A. | 常温下,5.6g金属铁投入足量的浓硫酸中,电子转移数为0.3NA | |
| B. | 18g D2O所含的中子数为10NA | |
| C. | 标准状况下,8 gSO3所含原子数为0.4NA | |
| D. | 常温下,1.0LpH=13的Ba (OH) 2溶液中含有的OH-数目为0.2NA |
| A. | 氨水和盐酸 | B. | 氢氧化钠溶液和醋酸 | ||
| C. | 硫酸和氢氧化钡溶液 | D. | 硝酸和石灰水 |
 .该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.
.该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.