题目内容
16.NaHSO4和NaHCO3是常见的酸式盐.请运用相关原理,回答下列问题:(1)NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-.室温下,pH=5的NaHSO4溶液中水的电离程度=(填“>”、“=”或“<”)pH=9的氨水中水的电离程度.
(2)等体积、等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因是:NH4++H2O?NH3.H2O+H+(用离子方程式表示).
(3)室温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH4+)>c(SO42-)(填“>”、“=”或“<”).
(4)室温下,用NaHSO4与Ba(OH)2溶液制取BaSO4,若溶液中SO42-完全沉淀,则反应后溶液的pH>7(填“>”、“=”或“<”).
(5)将NaHCO3溶液和NaAlO2溶液等体积混合,会产生白色沉淀,其主要原因是:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-(用离子方程式表示).
分析 (1)NaHSO4是强酸酸式盐,在水溶液中完全电离生成Na+、H+和SO42-;NaHCO3是弱酸酸式盐,在水溶液中完全电离生成Na+和HCO3-;酸或碱抑制水电离,酸中c(H+)或碱中c(OH-)越大,其抑制水电离程度越大;
(2)等体积、等物质的量浓度的NaHSO4与氨水混合后,二者恰好完全反应生成等物质的量浓度的Na2SO4和(NH4)2SO4,强酸强碱盐溶液呈中性,强酸弱碱盐中弱碱离子水解导致溶液呈酸性;
(3)溶液呈中性,说明溶液中c(H+)=c(OH-),根据电荷守恒判断;
(4)根据硫酸钡中钡离子和硫酸根离子关系式知,二者以1:1反应,反应后除了生成硫酸钡外还生成水和NaOH;
(5)向NaAlO2溶液中滴加饱和NaHCO3溶液,偏铝酸根离子促进HCO3-的电离.
解答 解:(1)NaHSO4是强酸酸式盐,在水溶液中完全电离生成Na+、H+和SO42-,其电离方程式为NaHSO4=Na++H++SO42-;NaHCO3是弱酸酸式盐,在水溶液中完全电离生成Na+和HCO3-;酸或碱抑制水电离,酸中c(H+)或碱中c(OH-)越大,其抑制水电离程度越大,pH=5的NaHSO4溶液中c(H+)=10-5 mol/L,
pH=9的氨水中c(OH-)=10-5 mol/L,则二者抑制水电离程度相等,
故答案为:NaHSO4=Na++H++SO42-;=;
(2)等体积、等物质的量浓度的NaHSO4与氨水混合后,二者恰好完全反应生成等物质的量浓度的Na2SO4和(NH4)2SO4,Na2SO4是强酸强碱盐、(NH4)2SO4是强酸弱碱盐,铵根离子水解导致溶液呈酸性NH4++H2O?NH3.H2O+H+,
故答案为:NH4++H2O?NH3.H2O+H+;
(3)溶液呈中性,说明溶液中c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(NH4+)=2c(SO42-),所以c(Na+)+c(NH4+)>c(SO42-),
故答案为:>;
(4)根据硫酸钡中钡离子和硫酸根离子关系式知,二者以1:1反应,反应后除了生成硫酸钡外还生成水和NaOH,则溶液呈碱性,溶液的pH>7,故答案为:>;
(5)向NaAlO2溶液中滴加饱和NaHCO3溶液,偏铝酸根离子促进HCO3-的电离,生成氢氧化铝程度和碳酸根离子,离子方程式为AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,
故答案为:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-.
点评 本题考查较综合,涉及酸碱混合溶液定性判断、电解质的电离、盐类水解、离子浓度大小比较等知识点,侧重考查学生分析判断能力,明确溶液中溶质成分及其性质是解本题关键,注意(5)题产生沉淀与盐类水解无关,为易错点.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 0.1mol/L的NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 通KSCN溶液变红色的溶液:NH4+、Al3+、SO42-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
| A. | 同分异构现象只存在于有机物和无机物之间 | |
| B. | 同分异构现象不存在于无机物之间 | |
| C. | 在无机化合物和有机化合物间一定存在同分异构现象 | |
| D. | 在无机化合物和有机化合物间可能存在同分异构现象 |
| A. | 常温下,5.6g金属铁投入足量的浓硫酸中,电子转移数为0.3NA | |
| B. | 18g D2O所含的中子数为10NA | |
| C. | 标准状况下,8 gSO3所含原子数为0.4NA | |
| D. | 常温下,1.0LpH=13的Ba (OH) 2溶液中含有的OH-数目为0.2NA |
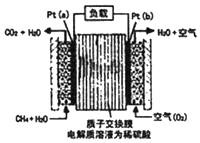 某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为:CH4+2O2═CO2+2H2O.下列有关说法正确的是( )
某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为:CH4+2O2═CO2+2H2O.下列有关说法正确的是( )| A. | 电子由a极流出经过负载流向b极 | |
| B. | 电解质溶液中H+移向a极 | |
| C. | 每转移1mole-,消耗1.6gCH4 | |
| D. | b极上的电极反应式为:O2+2H2O+4e-=4OH- |
 .该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.
.该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.


