题目内容
5.(1)元素周期表共有7个周期,16个族;按已知的原子结构规律,82号元素X在周期表中的位置为第6周期第ⅣA,它的最高正价氧化物的化学式为XO2或PbO2.(2)在${\;}_1^1$H、${\;}_1^2$H、${\;}_1^3$H、${\;}_{12}^{23}$Mg、${\;}_{12}^{24}$Mg和${\;}_{29}^{65}$Cu中,共有3种元素,6种原子.
(3)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥Ba(OH)2•8H2O与NH4Cl,属于放热反应③④⑤填序号),写出反应⑥的化学方程式Ba(OH)2•8H2O+2NH4Cl=BaCl2 +2NH3↑+10H2O.
分析 (1)周期表中7个横行,18列,共16个族,82号原子的原子结构中,电子层数=周期数=6,最外层电子数=族序数=4,主族元素的最高化合价数=其最外层电子数=4;
(2)质子数相同的为同种元素,具有不同质子和中子的原子为不同核素;
(3)常见的放热反应有:所有的燃烧、所有的中和反应、金属和酸的反应、金属与水的反应、大多数化合反应、铝热反应等;
常见的吸热反应为:大多数的分解反应,氢氧化钡和氯化铵的反应、焦炭和二氧化碳、焦炭和水的反应等,氢氧化钡与氯化铵反应生成氯化钡、氨气和水.
解答 解:(1)元素周期表共有7个周期,61个族,第六周期稀有气体的原子序数是86,则82号元素处于第六周期,周期表中与稀有气体相邻的85号元素处于ⅤⅡA族,84号元素处于ⅥA族,则82号元素处于ⅣA族,所以82元素位于周期表中ⅣA族,它的最高正价氧化物的化学式为XO2或PbO2,
故答案为:7个;16个;第6周期第ⅣA;XO2或PbO2;
(2)共有H、Mg、Cu3种元素,6种原子,故答案为:3;6;
(3)常见的放热反应有:所有的燃烧、所有的中和反应、金属和酸的反应、金属与水的反应、大多数化合反应、铝热反应等故放热反应的是③、④、⑤; 常见的吸热反应为:大多数的分解反应,氢氧化钡和氯化铵的反应、焦炭和二氧化碳、焦炭和水的反应等,所以吸热反应有:⑥,化学方程式:Ba(OH)2•8H2O+2NH4Cl=BaCl2 +2NH3↑+10H2O,
故答案为:③④⑤;Ba(OH)2•8H2O+2NH4Cl=BaCl2 +2NH3↑+10H2O.
点评 本题考查元素周期表的结构与应用,为高频考点,把握元素的位置、元素化合物知识、反应中能量变化等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥MgSO4固体.
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
| A. | BeCl2 | B. | H2S | C. | NCl3 | D. | BF3 |
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 由上表可知酸性HCOOH>H2CO3 | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| D. | 结合H+的能力:CO32->HCO3->CN->HCOO- |
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的单质能与其最高价氧化物反应 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
| A. | 中子数 | B. | 电子数 | C. | 原子序数 | D. | 质子数 |

 ;
;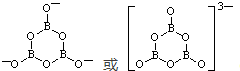 .
.