题目内容
17.硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有油腻感,可做润滑剂.硼酸对人体受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面.回答下列问题:
(1)B原子的结构示意图为
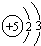 ;
;(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O═[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式H3BO3+OH-=B(OH)4-;
(3)下列有关硼酸晶体的说法正确的是B;
A.H3BO3分子的稳定性与氢键有关
B.含1molH3BO3的晶体中有3mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.B原子杂化轨道的类型sp2,同层分子间的主要作用力是范德华力
(4)根据对角线规则,与B性质相似的元素是Si.
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是AB;
A.HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=3;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数);
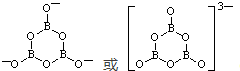 .
.
分析 (1)B的原子核外有5个电子,分两层排布;
(2)硼酸为一元弱酸,与氢氧根离子按照1:1反应;
(3)A.分子的稳定性与化学键有关;
B.利用均摊法计算含1molH3BO3的晶体中的氢键;
C.B原子形成3个共价键;
D.根据B原子的价层电子对判断其杂化类型;
(4)根据元素在周期表中位置判断;
(5)H3BO3的可改写为(HO)3BO0,非羟基氧原子数为0,据此分析;
(6)根据化合价的代数和等于电荷数计算;每个B原子形成3个共价键,每个O原子形成2个共价键.
解答 解:(1)B的原子核外有5个电子,分两层排布,其电子排布式为: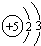 ;
;
故答案为: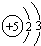 ;
;
(2)硼酸为一元弱酸,与氢氧根离子按照1:1反应,则硼酸与NaOH溶液反应的离子方程式H3BO3+OH-=B(OH)4-;
故答案为:H3BO3+OH-=B(OH)4-;
(3)A.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,故A错误;
B,1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,故B正确;
C.B原子形成3个共价键,即B原子周围有3个共用电子对,所以B周围有6个电子,不满足8电子结构,故C错误;
D.B只形成了3个单键,没有孤电子对,价层电子对数为3,所以采取sp2杂化,同层分子间的主要作用力是氢键,故D错误.
故答案为:B;
(4)根据元素在周期表中位置可知,B与Si在对角线位置,所以与B性质相似的元素是Si;故答案为:Si;
(5)H3BO3可改写为(HO)3BO0,非羟基氧原子数为0,
A.HClO可改写为(HO)ClO0,非羟基氧原子数为0,
B.H4SiO4可改写为(HO)4SiO0,非羟基氧原子数为0,
C.H3PO4可改写为(HO)3PO1,非羟基氧原子数为1,
D.HNO2可改写为(HO)NO1,非羟基氧原子数为1,
非羟基氧原子数相同,酸性相近,故AB符合;
故答案为:AB;
(6)B3O6n-中B为+3价,O为-2价,则n=3;每个B原子形成3个共价键,每个O原子形成2个共价键,则B3O63-的结构图为 ;
;
故答案为: .
.
点评 本题考查了原子结构示意图、氢键、8电子稳定结构、非羟基氧原子的判断、空间构型等,题目难度中等,主要考查学生阅读对题目信息与结构图获取知识的能力.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 60g乙酸与足量乙醇发生酯化反应.充分反应后断裂的C-O键数目为NA | |
| B. | 室温下向1LpH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| D. | 己知C2H4(g)+H2(g)=C2H4(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
| A. | 若HAOm是强酸,则HBOm也一定为强酸 | |
| B. | 若B为非金属元素,则A可能为金属元素,若B为金属元素,则A可能为非金属元素 | |
| C. | 常温下,若B的简单氢化物是气体,则A的简单氢化物可能是液体 | |
| D. | 若B(OH)m是强碱,则A(OH)m也是强碱 |
| A. | 一种阳离子和一种阴离子 | B. | 一种单质分子和一种化合物分子 | ||
| C. | 两种原子 | D. | 一种原子和一种分子 |
| A. | 氚原子符号:H | B. | H2O2分子结构式:H-O-O-H | ||
| C. | Mg2+结构示意图: | D. | HF的形成过程  |
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族的元素的原子次外层电子数不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物之间能两两反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
 .
.