题目内容
20.Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO> FeO(填“<”或“>”).分析 离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高,据此解答.
解答 解:Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO;
故答案为:>.
点评 本题考查离子晶体的物理性质的应用,做题时注意晶体熔点比较方法,题目难度不大,注意学习中有关做题方法的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种类型的是( )
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 干冰和氯化铵变成气体 |
12.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60g乙酸与足量乙醇发生酯化反应.充分反应后断裂的C-O键数目为NA | |
| B. | 室温下向1LpH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| D. | 己知C2H4(g)+H2(g)=C2H4(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
9.两种微粒的质子数和电子数都相等,它们不可能是( )
| A. | 一种阳离子和一种阴离子 | B. | 一种单质分子和一种化合物分子 | ||
| C. | 两种原子 | D. | 一种原子和一种分子 |
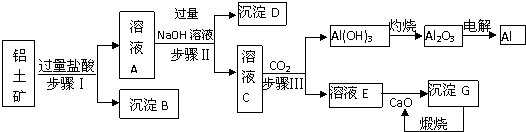
 .
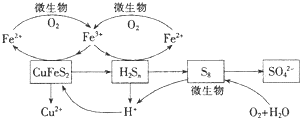
. 试回答:
试回答: .
.