题目内容
1.煤气化和液化是现代能源工业中重点考虑的能源综合利用方案.最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH.已知制备甲醇的有关化学反应及平衡常数如表所示:| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
(2)850℃时,在密闭容器中进行反应③开始时只加入CO2、H2,反应10min后测得各组分的浓度如表
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
②比较正逆反应的速率的大小:v正>v逆(填“>、<或=”)
③反应达到平衡后,保持其他条件不变,只把容器的体积缩小一半,平衡正向 (填“逆向”、“正向”或“不”),平衡常数 K3不变(填“增大”“减小”“不变”).如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
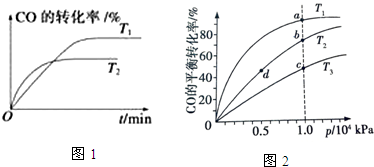
(3)由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如图2所示,则曲线 c 所表示的温度为350℃.实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
(4)以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3 OH的产率
D.某温度下,将2mol CO和6mol H2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol•L- 1,则CO的转化率为80%
分析 (1)①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
依据盖斯定律计算①+②得到CO(g)+2H2(g)═CH3OH(g)△H 3;
由反应方程式可知,K2=$\frac{{K}_{3}}{{K}_{1}}$;
(2)①根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
②计算此时的浓度商Qc,与平衡常数相比判断反应进行方向,据此判断速率大小;
③容器的体积缩小一半,压强增大,平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变;
(3)升高温度CO的转化率降低,曲线c转化来看最低,温度应最高,即为350℃,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
(4)A.反应前后气体的物质的量不等,恒温、恒容条件下同,若容器内的压强不发生变化,可说明可逆反应达到平衡;
B.无论是否达到平衡状态,都存在H2的消耗速率是CO的消耗速率的2倍;
C.催化剂不能使平衡发生移动;
D.计算c(CO)以及剩余CO的物质的量,可计算转化率.
解答 解:(1)①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
依据盖斯定律计算①+②得到CO(g)+2H2(g)═CH3OH(g)△H 3=-132.0 kJ/mol;
由反应方程式可知,K2=$\frac{{K}_{3}}{{K}_{1}}$=$\frac{160}{160}$=1;
故答案为:-132.0 kJ/mol;1;
(2)①由表中数据可知,l0min内甲醇的浓度变化为0.4mol/L,故v(CH3OH)=$\frac{0.4mol/L}{10min}$=0.04mol/(L•min),速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=3×0.04mol/(L•min)=0.12mol/(L•min);
故答案为:0.12mol/(L•min);
②10min时,二氧化碳的浓度为0.2mol/L,氢气的浓度为0.2mol/L,甲醇的浓度为0.4mol/L,水的浓度为0.4mol/L,故此时的浓度商Qc=$\frac{0.4×0.4}{0.2×0.2}$=4,小于平衡常数160,故反应向正反应进行,故v正>v逆,
故答案为:>;
③容器的体积缩小一半,压强增大,平衡向体积减小的方向移动,故平衡向正反应移动;
平衡常数只受温度影响,与压强无关,温度不变,平衡常数不变;
故答案为:正向;不变;
(3)升高温度CO的转化率降低,曲线c转化来看最低,温度应最高,即为350℃,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:350;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
(4)A.反应前后气体的物质的量不等,恒温、恒容条件下同,若容器内的压强不发生变化,可说明可逆反应达到平衡,故A正确;
B.无论是否达到平衡状态,都存在H2的消耗速率是CO的消耗速率的2倍,不能判断是否达到平衡状态,故B错误;
C.使用合适的催化剂能缩短达到平衡的时间,但不能使平衡发生移动,故C错误;
D.某温度下,将2molCO和6molH2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则剩余0.4molCO,则CO的转化率为$\frac{2mol-0.4mol}{2mol}$=80%,故D正确.
故答案为:AD.
点评 本题考查化学平衡计算与影响因素、平衡常数、化学反应速率计算及影响因素、化学平衡图象等,侧重于学生的分析能力和计算能力的考查,注意理解掌握平衡移动原理以及化学平衡的有关计算方法,难度中等.

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案| A. | 1 mol任何物质中都含有6.02×1023个分子 | |
| B. | 0.012 kg 12C中含有约6.02×1023 NA个碳原子 | |
| C. | 1 mol水中含有1 mol氢分子和1 mol氧原子 | |
| D. | 1 mol Ne中约含有6.02×1024个电子 |
| A. | 构成物质一定是化合物 | |
| B. | 构成物质一定是单质 | |
| C. | 构成物质可能只有一种元素 | |
| D. | 物质的组成元素一定是两种或两种以上 |
| A. | AlCl3 | B. | Cu(NO3)2 | C. | FeSO4 | D. | Na2CO3 |
| A. | 往氨水中滴加酚酞 | B. | NO气体暴露在空气中 | ||
| C. | Cl2通过湿润的有色布条 | D. | 往NaOH溶液中通入CO2 |
 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂
B.降低反应体系的温度
C.充入氩气使容器内压强增大
D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284 kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
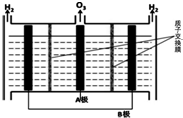
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
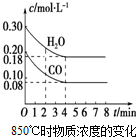 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0(1)在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol•(L•min)-1.
(2)t℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.110 | 0.210 | 0.090 | |
| 6 | 0.096 | 0.266 | 0.104 |
②表中3~4min之间反应处于平衡 状态.
③若第5min时,该反应处于化学平衡状态,则此反应的平衡常数K=0.35(保留两位有效数字)
④表中5~6min之间数值发生变化,可能的原因是B.
A.升高温度
B.体积不变,通入水蒸气
C.缩小体积,增大压强
D.体积不变,通入氢气
⑤比较反应物CO在2~3min、5~6min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)表示]的大小v(2~3)>v(5~6)(假设3~5min内反应条件不变).
⑥能使该反应的反应速率增大,且平衡向正反应方向移动的措施是C.
A.适当升高温度 B.缩小反应容器的体积C.增大CO的浓度 D.选择高效催化剂.
 ,其中氮的化合价为-2.
,其中氮的化合价为-2.