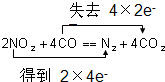题目内容
11.联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:(1)联氨分子的电子式为
 ,其中氮的化合价为-2.
,其中氮的化合价为-2.(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O_.
(3)①2O2(g)+N2(g)=N2O4(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4
上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1(用△H1、△H2、△H3表示).
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为8.5×10-7
(已知:N2H4+H+?N2H5+ K=8.5×107;Kw=1.0×10-14).联氨与硫酸形成的酸式盐的化学式为N2H6(HSO4)2.
分析 (1)N2H4是氮原子和氢原子形成四个共价键,氮原子和氮原子间形成一个共价键形成的共价化合物,元素化合价代数和为0计算化合价;
(2)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠;
(3)已知:①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
依据盖斯定律计算③×2-②×2-①可得;
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2O?N2H5++OH-,平衡常数Kb=$\frac{c({N}_{2}{{H}_{5}}^{+})•c(O{H}^{-})}{c({N}_{2}{H}_{4})}$=$\frac{c({N}_{2}{{H}_{5}}^{+})•c(O{H}^{-})}{c({N}_{2}{H}_{4})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=K×Kw,由于是二元碱,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2.
解答 解:(1)肼的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为 ;其中氢元素化合价为+1价,则氮元素化合价为-2价;
;其中氢元素化合价为+1价,则氮元素化合价为-2价;
故答案为额: ;-2;
;-2;
(2)(2)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠,结合原子守恒配平书写反应的化学方程式为:ClO-+2NH3=N2H4+Cl-+H2O;
故答案为:ClO-+2NH3=N2H4+Cl-+H2O;
(3)已知:①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
依据盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1;
故答案为:△H4=2△H3-2△H2-△H1;
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2O?N2H5++OH-,平衡常数Kb=$\frac{c({N}_{2}{{H}_{5}}^{+})•c(O{H}^{-)}}{c({N}_{2}{H}_{4})}$=$\frac{c({N}_{2}{{H}_{5}}^{+})•c(O{H}^{-})}{c({N}_{2}{H}_{4})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=K×Kw=8.7×107×1.0×10-14=8.7×10-7,第二步电离方程式为N2H5++H2O?N2H62++OH-,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;
故答案为:8.5×10-7;N2H6(HSO4)2.
点评 本题考查了氮及其化合物性质、物质结构、热化学方程式和盖斯定律计算应用、平衡常数的计算方法,题目难度中等.

| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
(2)850℃时,在密闭容器中进行反应③开始时只加入CO2、H2,反应10min后测得各组分的浓度如表
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
②比较正逆反应的速率的大小:v正>v逆(填“>、<或=”)
③反应达到平衡后,保持其他条件不变,只把容器的体积缩小一半,平衡正向 (填“逆向”、“正向”或“不”),平衡常数 K3不变(填“增大”“减小”“不变”).如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
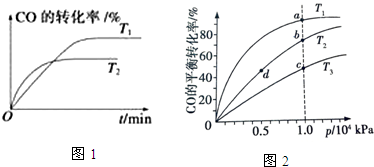
(3)由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如图2所示,则曲线 c 所表示的温度为350℃.实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
(4)以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3 OH的产率
D.某温度下,将2mol CO和6mol H2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol•L- 1,则CO的转化率为80%
| A. | 常温下,46g NO2和N2O4含有2NA个氧原子 | |
| B. | 1mol Na中约含NA个电子 | |
| C. | 4gNaOH中含有NA个OH- | |
| D. | 标况下,22.4LHF中含有NA个HF分子 |
| A. | 同质量H2与Cl2,H2的分子数比Cl2多 | |
| B. | 摩尔是用来衡量微观粒子多少的物理量 | |
| C. | 0.1molH2SO4含有氢原子数的精确值为1.204×1023 | |
| D. | 0.5mol氢的质量是0.5g |
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氢氧化钠的摩尔质量是40 g | |
| C. | 1mol H2SO4中含有1mol H2 | |
| D. | 氩气的摩尔质量在数值上等于它的相对原子质量 |
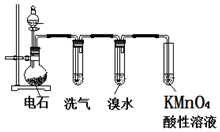 如图为实验室制取乙炔并验证其性质的装置图,回答下列问题:
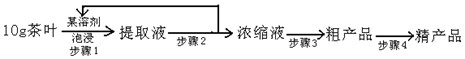
如图为实验室制取乙炔并验证其性质的装置图,回答下列问题: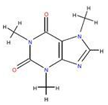 ,实验室可通过下列简单方法从茶叶中提取咖啡因:
,实验室可通过下列简单方法从茶叶中提取咖啡因: