题目内容
3.蒸干下列溶液能得到原溶液中溶质的是( )| A. | AlCl3 | B. | Cu(NO3)2 | C. | FeSO4 | D. | Na2CO3 |
分析 如果溶质在加热过程中不分解、不水解生成易挥发的物质就能得到原溶液中的溶质,据此分析解答.
解答 解:A.加热氯化铝溶液时,氯化铝水解生成氢氧化铝和HCl,HCl具有挥发性,加热促进其挥发,所以蒸干时得到的固体是氢氧化铝,故A错误;
B.加热硝酸铜溶液时,硝酸铜水解生成氢氧化铜和硝酸,硝酸具有挥发性,加热促进其挥发,所以蒸干时得到的固体是氢氧化铜,故B错误;
C.硫酸亚铁易被氧化为硫酸铁,三价铁水解为氢氧化铁和硫酸,硫酸不挥发,二者继续反应生成硫酸铁,即最后得到硫酸铁,故C错误;
D.碳酸钠在溶液在加热时水解得到碳酸氢钠与氢氧化钠,但氢氧化钠和碳酸氢钠难挥发,最后又重新得到的固体Na2CO3,所以能得到原溶质,故D正确;
故选D.
点评 本题考查盐类水解的应用,为高频考点,侧重学生的分析能力的考查,题目难度不大,注意盐类水解的原理,特别是把握相关物质的性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.5 mol Al与足量盐酸反应转移电子数为1NA | |
| B. | 500mL 1mol/LNa2CO3溶液中,含有Na+离子数目为NA | |
| C. | 常温常压下,11.2LO2(g)中含有O2分子数目为0.5NA | |
| D. | 标准状况下,11.2 L H2O所含的分子数为0.5 NA |
18.下列说法正确的是( )
| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 | |
| C. | 纯水呈中性是因为水中c(H+)和c(OH-)相等 | |
| D. | NaHCO3与Na2SO4溶液的混合溶液呈中性 |
8.0.01mol氯化铬(CrCl3•6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.已知Cr3+的配位数为6,则此氯化铬化学式是( )
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
1.煤气化和液化是现代能源工业中重点考虑的能源综合利用方案.最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH.已知制备甲醇的有关化学反应及平衡常数如表所示:
(1)则反应△H3=-132.0 kJ/mol K21
(2)850℃时,在密闭容器中进行反应③开始时只加入CO2、H2,反应10min后测得各组分的浓度如表
①该时间段内反应速率v(H2)=0.12mol/(L•min)
②比较正逆反应的速率的大小:v正>v逆(填“>、<或=”)
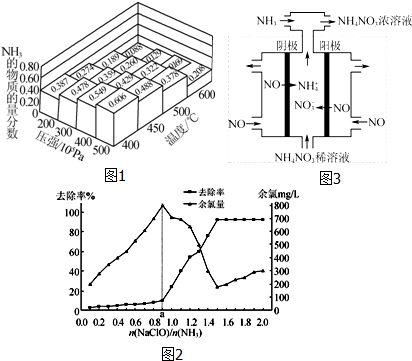
③反应达到平衡后,保持其他条件不变,只把容器的体积缩小一半,平衡正向 (填“逆向”、“正向”或“不”),平衡常数 K3不变(填“增大”“减小”“不变”).如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
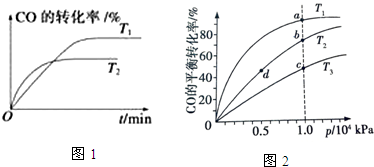
(3)由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如图2所示,则曲线 c 所表示的温度为350℃.实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
(4)以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3 OH的产率
D.某温度下,将2mol CO和6mol H2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol•L- 1,则CO的转化率为80%
| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
(2)850℃时,在密闭容器中进行反应③开始时只加入CO2、H2,反应10min后测得各组分的浓度如表
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
②比较正逆反应的速率的大小:v正>v逆(填“>、<或=”)
③反应达到平衡后,保持其他条件不变,只把容器的体积缩小一半,平衡正向 (填“逆向”、“正向”或“不”),平衡常数 K3不变(填“增大”“减小”“不变”).如图1是该反应在不同温度下CO的转化率随时间变化的曲线.

(3)由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如图2所示,则曲线 c 所表示的温度为350℃.实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
(4)以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3 OH的产率
D.某温度下,将2mol CO和6mol H2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol•L- 1,则CO的转化率为80%
19.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温下,46g NO2和N2O4含有2NA个氧原子 | |
| B. | 1mol Na中约含NA个电子 | |
| C. | 4gNaOH中含有NA个OH- | |
| D. | 标况下,22.4LHF中含有NA个HF分子 |