题目内容
6. NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂
B.降低反应体系的温度
C.充入氩气使容器内压强增大
D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284 kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
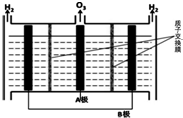
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
分析 Ⅰ.(1)根据表格中数据算出前2s内的平均反应速率υ(NO)=(1.00×10-3-1.70×10-4 )÷2=4.15×10-4mol/(L•s),根据化学反应速率之比等于化学计量数之比,υ(N2)=1/2υ(NO)=2.08×10-4 mol/(L•s);由表格数据看出第3s后c(NO)不变则达平衡,此时c(CO)=1.00×10-4mol•L-1,c(CO2)=1.00×10-3mol•L-1 -1.00×10-4mol•L-1=9.00×10-4mol•L-1,c(N2)=1/2c(CO2)=4.50×10-4mol•L-1,根据K=c(CO2)2×c(N2)/(c(NO)2×c(CO)2)=3.65×106;
(2)达到平衡时,要提高NO转化率,即改变条件要使平衡正向移动,
A.选用更有效的催化剂,平衡不移动;
B.降低反应体系的温度,该反应为放热反应,正向移动;
C.充入氩气使容器内压强增大,平衡不移动;
D.充入CO使容器内压强增大,相当于增大CO浓度,平衡正向移动,NO转化率提高;
(3)由已知方程①2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=-748kJ/mol及②N2(g)+O2(g)=2NO(g)△H=+180kJ/mol.根据盖斯定律①÷2+②÷2得CO的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g)△H=(-748kJ/mol)÷2+(+180kJ/mol)÷2=-284 kJ/mol;
Ⅱ.(4)O3氧化NO结合水洗可产生HNO3和O2,转移电子数=化合价升高数,NO转化为HNO3 ,化合价升高3,每生成1mol的HNO3转移3mol电子;
(5)根据已知图,A极出来的是O3,B极出来的是H2,说明A极发生的氧化反应为阳极,B极发生还原反应为阴极,阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+
解答 解:Ⅰ.(1)根据表格中数据算出前2s内的平均反应速率υ(NO)=(1.00×10-3-1.70×10-4 )÷2=4.15×10-4mol/(L•s),根据化学反应速率之比等于化学计量数之比,υ(N2)=1/2υ(NO)=2.08×10-4 mol/(L•s);由表格数据看出第3s后c(NO)不变则达平衡,此时c(CO)=1.00×10-4mol•L-1,c(CO2)=1.00×10-3mol•L-1 -1.00×10-4mol•L-1=9.00×10-4mol•L-1,c(N2)=1/2c(CO2)=4.50×10-4mol•L-1,根据K=c(CO2)2×c(N2)/(c(NO)2×c(CO)2)=3.65×106,
故答案为:2.08×10-4 mol/(L•s);3.65×106;
(2)达到平衡时,要提高NO转化率,即改变条件要使平衡正向移动,
A.选用更有效的催化剂,平衡不移动,故A错误;
B.降低反应体系的温度,该反应为放热反应,正向移动,故B正确;
C.充入氩气使容器内压强增大,平衡不移动,故C错误;
D.充入CO使容器内压强增大,相当于增大CO浓度,平衡正向移动,NO转化率提高,故D正确.
故答案为:BD;
(3)由已知方程①2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=-748kJ/mol及②N2(g)+O2(g)=2NO(g)△H=+180kJ/mol.根据盖斯定律①÷2+②÷2得CO的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g)△H=(-748kJ/mol)÷2+(+180kJ/mol)÷2=-284 kJ/mol,
故答案为:284 kJ/mol;
Ⅱ.(4)O3氧化NO结合水洗可产生HNO3和O2,转移电子数=化合价升高数,NO转化为HNO3 ,化合价升高3,每生成1mol的HNO3转移3mol电子,故答案为:3;
(5)根据已知图,A极出来的是O3,B极出来的是H2,说明A极发生的氧化反应为阳极,B极发生还原反应为阴极,阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+,
故答案为:B;3H2O-6e-=O3+6H+.
点评 本题考查了反应速率、平衡常数、转化率的计算,反应能量变化的分析判断和热化学方程式的书写,化学平衡的影响因素分析应用,平衡常数计算,电极方程式的书写等,掌握基础是解题关键,题目难度中等.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | Na+的电子式: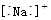 | B. | Na+的结构示意图: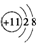 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:3s1 |
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
(2)850℃时,在密闭容器中进行反应③开始时只加入CO2、H2,反应10min后测得各组分的浓度如表
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
②比较正逆反应的速率的大小:v正>v逆(填“>、<或=”)
③反应达到平衡后,保持其他条件不变,只把容器的体积缩小一半,平衡正向 (填“逆向”、“正向”或“不”),平衡常数 K3不变(填“增大”“减小”“不变”).如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
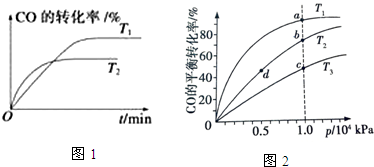
(3)由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如图2所示,则曲线 c 所表示的温度为350℃.实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
(4)以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3 OH的产率
D.某温度下,将2mol CO和6mol H2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol•L- 1,则CO的转化率为80%
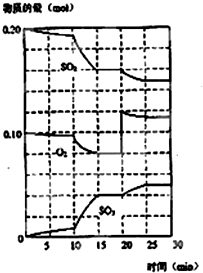 在一定条件下,二氧化硫和氧气发生如图反应:
在一定条件下,二氧化硫和氧气发生如图反应:
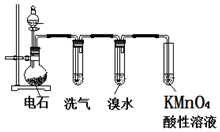 如图为实验室制取乙炔并验证其性质的装置图,回答下列问题:
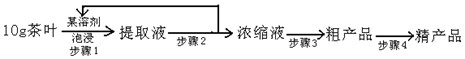
如图为实验室制取乙炔并验证其性质的装置图,回答下列问题: ,实验室可通过下列简单方法从茶叶中提取咖啡因:
,实验室可通过下列简单方法从茶叶中提取咖啡因: