题目内容
7.火箭推进器中装有还原剂肼(N2H4,又名联氨)和强氧化剂过氧化氢(H2O2),当它们混合时,立即产生大量氮气和水蒸气,并放出大量热.(1)写出过氧化氢的电子式
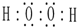 ;肼的结构式
;肼的结构式 ;
;(2)已知0.4mol液态肼和足量液态过氧化氢反应,生成氮气和水蒸气时放出256.6KJ的热量,写出反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5kJ/mol;
(3)火箭推进器中的氧化剂还可以用NO2代替.已知有以下反应:
①N2(g)+2O2(g)═2NO2(g)△H1=+67.7KJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2=-534KJ/mol
写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
(4)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是生成N2和H2O,对环境无污染.
分析 (1)肼分子式为NH2-NH2,每个氮原子形成三个化学键,过氧化氢分子式H2O2,每个氧原子形成两个共价键,据此书写;
(2)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(3)依据热化学方程式和盖斯定律计算得到热化学方程式;
(4)肼燃烧生成氮气和水.
解答 解:(1)过氧化氢分子式H2O2,每个氧原子形成两个共价键,分子的电子式为: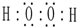 ;肼分子式为NH2-NH2,每个氮原子形成三个化学键,结构式为:
;肼分子式为NH2-NH2,每个氮原子形成三个化学键,结构式为: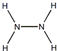 ;
;
故答案为: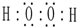 ;
; ;
;
(2)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量,32g肼燃烧放热641.625kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5kJ/mol;
(3)已知①N2(g)+2O2(g)═2NO2(g);△H=+67.7KJ/mol,
②N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534KJ/mol,
依据盖斯定律②×2-①得到肼与NO2完全反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
(4)肼燃烧生成氮气和水,除释放大量热和快速产生大量气体外,生成的物质无污染.
故答案为:生成N2和H2O,对环境无污染.
点评 本题考查了化学反应能量变化的计算应用,物质结构分析判断,盖斯定律的计算,热化学方程式书写方法,题目难度中等.

练习册系列答案
相关题目
18.下列有关物质说法正确的是( )
| A. | 加热NH4Cl只破坏离子键 | |
| B. | 4.48L氨气中含有0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | 某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4、H2X |
2.下列事实与氢键无关的是( )
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | NH3易液化 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
12.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 甲烷的结构式:CH4 | B. | NH4Cl的电子式: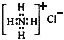 | ||
| C. | 苯的实验式:CH | D. | 乙烯的结构简式:C2H4 |
19.下列说法中正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 非金属元素之间不可能形成离子化合物 | |
| C. | 气体分子间一定存在分子间作用力,但分子内不一定含共价键 | |
| D. | 两种不同的非金属元素形成的化合物只存在极性共价键 |
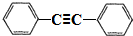 ,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: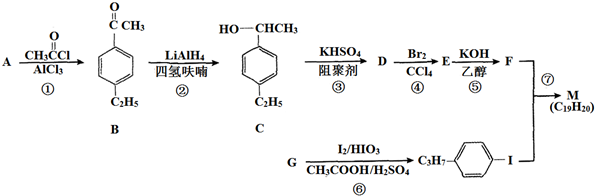
 ,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;
,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;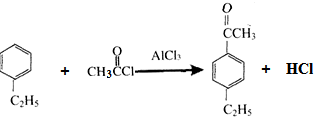 ,④的反应类型是加成反应;
,④的反应类型是加成反应;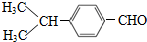 (写结构简式);
(写结构简式); 的合成路线
的合成路线 .
.

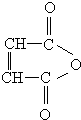 .
.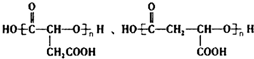 .
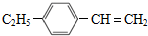
.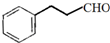 )与F的相对分子质量相同,其中满足下列条件的X的同分异构体有14种(含X本身).
)与F的相对分子质量相同,其中满足下列条件的X的同分异构体有14种(含X本身). 的最简合成线路.
的最简合成线路.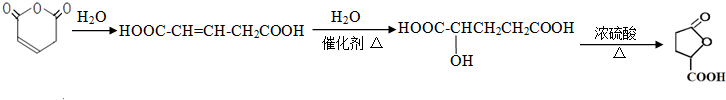 .
.