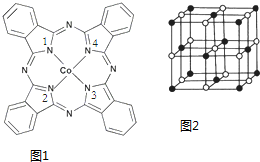
题目内容
12.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )| A. | 甲烷的结构式:CH4 | B. | NH4Cl的电子式: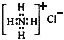 | ||
| C. | 苯的实验式:CH | D. | 乙烯的结构简式:C2H4 |
分析 A.甲烷的结构式中,需要用短线表示出C-H键;
B.氯化铵为离子化合物,氯离子需要标出所带电荷;
C.实验式为分子中各原子的最简比,根据苯的分子式C6H6判断;
D.乙烯的结构简式中没有标出碳碳双键.
解答 解:A.甲烷分子式为CH4,碳原子与氢原子之间形成1对共用电子对,结构式为: ,故A错误;
,故A错误;
B.氯化铵是离子化合物,由氨根离子与氯离子构成,其正确的电子式为 ,故B错误;
,故B错误;
C.苯的分子式为C6H6,则苯的最简式为CH,故C正确;
D.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度不大,涉及电子式、结构式、结构简式、最简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
相关题目
2.下列有关晶体的说法正确的是( )
| A. | 任何晶体中都存在化学键 | |
| B. | 固体SiO2一定是晶体 | |
| C. | 晶体的自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象 | |
| D. | X-射线衍射法是区分晶体和非晶体的唯一方法 |
3.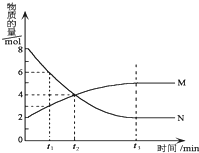 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为M═2N | |
| B. | 若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率等于逆反应速率 |
17.在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ•mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
(1)根据上表中的数据判断工业合成氨的反应是放热(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应. 理论上放出或吸收的热量为Q1,则Q1为93KJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是B
A.Q1>Q2B.Q1<Q2 C.Q1=Q2.
| 共价键 | H2分子 | N2分子 | NH3分子 |
| 键能(KJ•mo1-1) | 436 | 945 | 391 |
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应. 理论上放出或吸收的热量为Q1,则Q1为93KJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是B
A.Q1>Q2B.Q1<Q2 C.Q1=Q2.
4.已知短周期元素的离子 aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 离子半径 C>D>B>A | B. | 原子序数 d>c>b>a | ||
| C. | 单质的活泼性 A>B,D>C | D. | 原子半径 A>B>D>C |
2.苯甲酸应用广泛.实验室用甲苯的氧化制备苯甲酸,反应原理:
3 ─CH3+6KMnO4→3
─CH3+6KMnO4→3 ─COOK+6MnO2+3KOH+3H2O
─COOK+6MnO2+3KOH+3H2O
 ─COOK+HCl→
─COOK+HCl→ ─COOH+KCl
─COOH+KCl
反应试剂、产物的物理常数:
主要实验装置和流程如下(加热装置等略去):
实验方法:
一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,然后按如下流程分离出苯甲酸和回收未反应的甲苯.

(1)无色液体A的结构简式为 ,操作Ⅱ为蒸馏.
,操作Ⅱ为蒸馏.
(2)如果水层呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.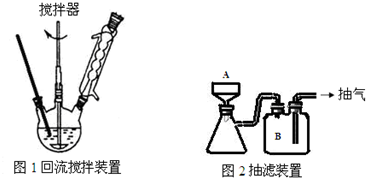
A.图2是抽滤,容器B可以省略
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.图2中仪器A是布氏漏斗
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)证明白色固体B是纯净物测量白色固体B的熔点为122.4℃.
(6)证明苯甲酸是弱酸取0.01mol/L的苯甲酸溶液,测得pH>2.
3
 ─CH3+6KMnO4→3
─CH3+6KMnO4→3 ─COOK+6MnO2+3KOH+3H2O
─COOK+6MnO2+3KOH+3H2O ─COOK+HCl→
─COOK+HCl→ ─COOH+KCl
─COOH+KCl反应试剂、产物的物理常数:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
实验方法:
一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,然后按如下流程分离出苯甲酸和回收未反应的甲苯.

(1)无色液体A的结构简式为
 ,操作Ⅱ为蒸馏.
,操作Ⅱ为蒸馏.(2)如果水层呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.

A.图2是抽滤,容器B可以省略
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.图2中仪器A是布氏漏斗
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)证明白色固体B是纯净物测量白色固体B的熔点为122.4℃.
(6)证明苯甲酸是弱酸取0.01mol/L的苯甲酸溶液,测得pH>2.
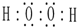 ;肼的结构式
;肼的结构式 ;
;