题目内容
15.某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间最终变为C,B和气体D能生成C,A和B都能与水生成E,E和D也能生成C.回答下列问题.(1)写出下列物质的化学式:BNa2O2,CNa2CO3,
(2)写出下列反应的离子方程式:
①A和水生成E:2Na+2H2O═2Na++2OH-+H2↑
②E与D生成C:CO2+2OH-=CO32-+H2O
(3)E物质是否属于电解质是(填:是、否)
分析 某银白色金属单质A在空气中加热燃烧时发出黄色火焰,则A是Na,得到淡黄色固体B,钠在空气燃烧生成淡黄色固体过氧化钠,则B是Na2O2,钠露置在空气中足够长时间变为Na2CO3,所以C是Na2CO3,过氧化钠和气体D反应生成Na2CO3,则D是CO2,E和二氧化碳反应也生成Na2CO3,钠、过氧化钠和水反应都生成氢氧化钠,则E是NaOH,结合物质的性质解答该题.
解答 解:某银白色金属单质A在空气中加热燃烧时发出黄色火焰,则A是Na,得到淡黄色固体B,钠在空气燃烧生成淡黄色固体过氧化钠,则B是Na2O2,钠露置在空气中足够长时间变为Na2CO3,所以C是Na2CO3,过氧化钠和酸性气体D反应生成Na2CO3,则D是CO2,E和二氧化碳反应也生成Na2CO3,钠、过氧化钠和水反应都生成氢氧化钠,则E是NaOH,
(1)通过以上分析知,B、C分别是Na2O2、Na2CO3,
故答案为:Na2O2;Na2CO3;
(2)①A为Na,与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
②E为NaOH,D是CO2,二者反应生成碳酸钠和水,反应的离子方程式为CO2+2OH-=CO32-+H2O,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;CO2+2OH-=CO32-+H2O;
(3)E是NaOH,为离子化合物,在熔融状态下可导电,为电解质,
故答案为:是.
点评 本题考查了钠及其化合物之间的转化,明确钠及其化合物的性质是解本题关键,以“A的颜色及焰色反应、B的颜色”为突破口来分析解答,注意钠放置在空气中很长时间后最终变为碳酸钠,难度不大.

练习册系列答案
相关题目
5.溶液的酸碱性对人们的生活有着较大的影响.常温下,下列溶液中酸性最弱的是( )
| A. | pH=4 | B. | c(H+)=0.001 mol•L-1 | ||
| C. | c(OH- )=1×10-11 mol•L-1 | D. | c(H+):c(OH- )=1×104 |
6.金属锂是密度最小的金属,常用来制造高能量电池.已知锂的金属性介于钠和镁之间,则冶炼出金属锂的方法应该是( )
| A. | 电解法 | B. | 热还原法 | C. | 热分解法 | D. | 铝热法 |
3.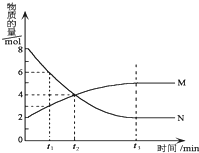 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为M═2N | |
| B. | 若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率等于逆反应速率 |
4.已知短周期元素的离子 aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 离子半径 C>D>B>A | B. | 原子序数 d>c>b>a | ||
| C. | 单质的活泼性 A>B,D>C | D. | 原子半径 A>B>D>C |
5.下列说法正确的是( )
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=-( Ea-Eb)kJ/mol | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20% | |
| D. | 将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
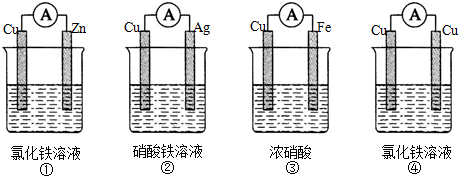
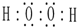 ;肼的结构式
;肼的结构式 ;
;