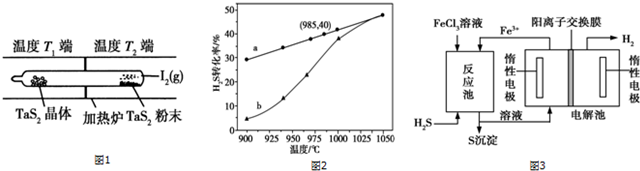
题目内容
18.下列有关物质说法正确的是( )| A. | 加热NH4Cl只破坏离子键 | |
| B. | 4.48L氨气中含有0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | 某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4、H2X |
分析 A.加热氯化铵时,氯化铵分解生成氨气和氯化氢;
B.温度和压强未知导致气体摩尔体积未知;
C.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6;
D.主族元素其最高化合价与其族序数相等,其最低化合价=族序数-8.
解答 解:A.加热氯化铵时,氯化铵分解生成氨气和氯化氢,破坏离子键和共价键,故A错误;
B.温度和压强未知导致气体摩尔体积未知,所以无法计算N-H键个数,故B错误;
C.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6,Cl原子的最外层电子数为8,故C错误;
D.主族元素其最高化合价与其族序数相等,其最低化合价=族序数-8,所以某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4、H2X,故D正确;
故选D.
点评 本题考查离子键、物质的量有关计算、8电子稳定结构、元素化合价等知识点,为高频考点,明确化学键、物质的量公式、元素周期律等知识点是解本题关键,易错点是C.

练习册系列答案
相关题目
8.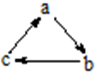 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HCl | H2CO3 | HClO |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | NaHCO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
9.除去下列有机物中的杂质,所选试剂正确的是(括号中的是杂质)( )
| A. | 乙烯(乙炔):酸性高锰酸钾溶液 | |
| B. | 溴苯(苯):液溴、铁粉 | |
| C. | 乙烷(乙烯):氢气、镍 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、氢氧化钠溶液 |
6.金属锂是密度最小的金属,常用来制造高能量电池.已知锂的金属性介于钠和镁之间,则冶炼出金属锂的方法应该是( )
| A. | 电解法 | B. | 热还原法 | C. | 热分解法 | D. | 铝热法 |
13.下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | CO2+C $\frac{\underline{\;高温\;}}{\;}$ 2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | NaOH+HCl═NaCl+H2O |
3.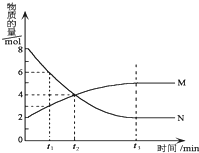 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为M═2N | |
| B. | 若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率等于逆反应速率 |
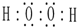 ;肼的结构式
;肼的结构式 ;
;