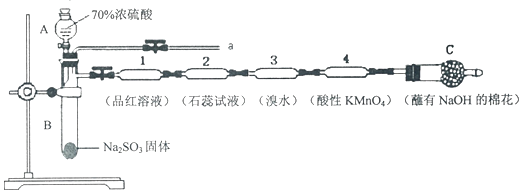
题目内容
5.甲醛(HCHO)与葡萄糖相似具有还原性.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.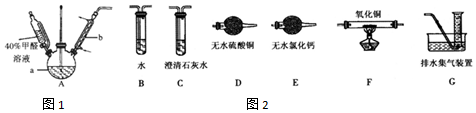
(1)在图1装置中进行实验,向a中加入0.5mol•L-1CuSO4溶液50mL和5mol•L-1NaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a 20分钟后冷却至室温.
①仪器b的名称是球形冷凝管;
②能说明甲醛具有还原性的实验现象是a中出现砖红色物质.
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种.为确认气体成分,将装置A和如图2所示装置连接后进行实验.
依次连接的合理顺序为A→B→E→F→D→C→G,装置B的作用是吸收甲醛蒸气,防止其干扰后续检验.有H2的实验现象是F中黑色固体变红色,D中固体变蓝色.
(3)已知
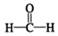 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$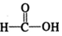 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$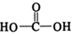 (H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.
(H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.(4)反应后a中有红色固体产生,为研究其组成,进行如下实验(以下每步均充分反应):
已知:CuO$\stackrel{易溶于浓氨水}{→}$[Cu(NH3)4]+(无色)$\stackrel{在空气中}{→}$[Cu(NH3)4]2+(蓝色),溶解得深蓝色溶液的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近.由此可知固体产物的组成及物质的量之比约为n(Cu2O):n(Cu)=1:200.
分析 (1)①根据仪器构造可知;
②甲醛具有还原性,和新制氢氧化铜加热反应生成氧化亚铜红色沉淀;
(2)为确认产生的气体为CO、H2中的一种或两种,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体.据此设计实验验证;
(4)①锥形瓶ⅱ中固体完全溶解得深蓝色溶液是铜、氧气和一水合氨溶液反应生成深蓝色络离子;
②反应现象和元素守恒得到固体物质组成为氧化亚铜和铜,将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近说明浓度相同.
解答 解:(1)①仪器b为球形冷凝管;
故答案为:球形冷凝管;
②能说明甲醛具有还原性的实验现象是和新制氢氧化铜加热反应生成氧化亚铜红色沉淀,即a中出现砖红色物质;
故答案为:a中出现砖红色物质;
(2)为确认产生的气体为CO、H2中的一种或两种,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体,依次连接的合理顺序为ABEFDCG,装置B的作用是吸收甲醛蒸气,防止其干扰后续检验;F中黑色固体变红色,D中固体变蓝色说明有氢气生成;
故答案为:E→F→D→C;吸收甲醛蒸气,防止其干扰后续检验;F中黑色固体变红色,D中固体变蓝色;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体.设计实验证明a中甲醛的碳元素未被氧化成+4价的方法为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价;
故答案为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价;
(4)①锥形瓶ⅱ中固体完全溶解得深蓝色溶液是铜、氧气和一水合氨溶液反应生成深蓝色络离子,反应的离子方程式为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
故答案为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
②将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近.由此可知固体产物的组成及物质的量之比约为n(Cu2O):n(Cu)=1:200;
故答案为:n(Cu2O):n(Cu)=1:200.
点评 本题考查了物质组成的实验探究、物质性质、反应现象、实验关系分析判断,掌握基础是解题关键,题目难度中等.

| A. | 物质均由原子或分子构成 | |
| B. | 已知的大部分物质属于有机物 | |
| C. | 食品加工中应严禁使用人工合成的物质 | |
| D. | 干冰、可燃冰属于同种物质 |
| A. | 1L2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| B. | 电解精炼铜时,若阴极得电子数为2NA,则阳极质量减少64g | |
| C. | 1mol聚苯乙烯分子有碳碳双键的数目为NA | |
| D. | 1molMg在空气中燃烧生成MgO(含少量Mg3N2)失去电子数为2NA |
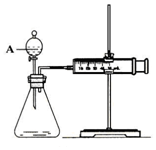 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表| 时间/s | 0 | t | 2t | … |
| 活塞的位置/ml | 17.3 | 25.6 | 36.6 | … |
(2)仪器A的名称是分液漏斗.
(3)0-t时间段与t-2t时间段,化学反应速率最快的是t-2t,原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0,1mol/LFeCl3、0.2mol/LCuCl2,完成表的实验设计:
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
 .
.②上表中需要添加的物质是4mlFeCl3溶液.
③本实验需要测定的数据是收集相同体积的氧气所需时间(或相同时间产生氧气的体积).
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如表.
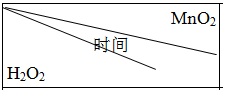 | 0.1g | 0.3g | 0.8g |
| 10mL1.5% | 223s | 67s | 36s |
| 10mL3.0% | 308s | 109s | 98s |
| 10mL4.5% | 395s | 149s | 116s |
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而加快(填“加快”、“减慢”或“不变”).
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入0.3 g的MnO2为较佳选择.
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?不正确(填“正确”或“不正确”),理由是H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多.(提示:H2O2溶液的密度可认为近似相等.)
| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素A、C电负性大小关系为A>C |
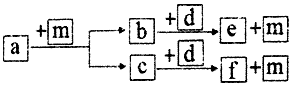 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Z>Y | |
| B. | Z2Y2中既含有离子键又含有共价键,其中阳离子和阴离子的比值为2:1 | |
| C. | 简单气态氢化物的热稳定性:Y>X | |
| D. | 由上述4种元素组成的化合物属于离子化合物 |
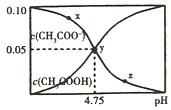 常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )
常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )| A. | 溶液的pH比较:x>y>z | |
| B. | 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| C. | 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点 | |
| D. | 该温度下,CH3COONa的Kb=10-4.75 |
| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若向3种溶液都通入足量二氧化碳,pH变化最大的是② | |
| C. | 若分别加入25mL0.1mol•L-1盐酸后,pH最小的是③ | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③ |