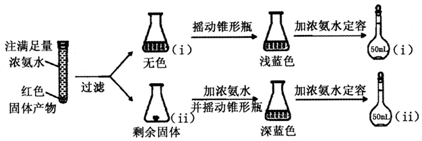
题目内容
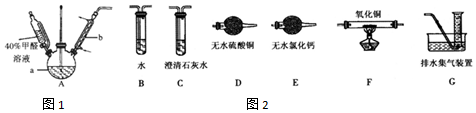
17.为了验证SO2的性质,某同学利用输液管设计了如下微型实验: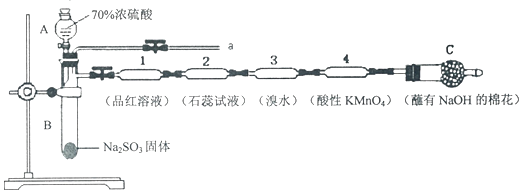
请回答:
(1)仪器A的名称是分液漏斗.
(2)装置C中NaOH的作用是吸收二氧化硫,防止污染空气.
(3)下列说法正确的是BC.
A.装置l、3、4中溶液均褪色,可证明SO2具有漂白性
B.装置2中石蕊试液只变红不褪色,证明SO2是一种酸性氧化物
C.反应结束后,可由a导管向装置中加水,将气体赶出后再拆装置
D.可在a导管处用向下排空气法收集SO2.
分析 浓硫酸和亚硫酸钠固体反应生成二氧化硫,通入1中品红溶液中溶液褪色,通过2中石蕊试液变红色证明二氧化硫溶于水显酸性,通过装置3中溴水能氧化二氧化硫,溴水褪色,证明二氧化硫的还原性,通过装置4中酸性高锰酸钾褪色,说明二氧化硫的还原性,最后通过装置C吸收剩余二氧化硫,据此分析解答.
解答 解:(1)仪器A为分液漏斗;
故答案为:分液漏斗;
(2)二氧化硫有毒,不能直接排放于空气中,装置C中NaOH可以吸收二氧化硫,防止污染空气;
故答案为:吸收二氧化硫,防止污染空气;
(3)A.装置1证明二氧化硫漂白性具有可逆性,装置2、3证明二氧化硫有还原性,故A错误;
B.二氧化硫溶于水和水反应SO2+H2O=H2SO3,亚硫酸遇到石蕊变红色,证明SO2是一种酸性氧化物,故B正确;
C.实验结束后,可由a导管向装置中加水,将装置中气体赶出,防止残留的SO2有毒气体污染环境,故C正确;
D.SO2气体比空气重,在a导管处用向上排空气法收集SO2,故D错误;
故答案为:BC.
点评 本题考查二氧化硫的性质,为高频考点,涉及气体的制备及收集、物质性质的分析等,把握物质的性质、反应原理、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
8.我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是( )
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数少 | |
| C. | 5.2 g 26Al3+中所含的电子数约为1.2×1024 | |
| D. | 26Al和26Mg的质子数、中子数和核外电子数都不相同 |
12.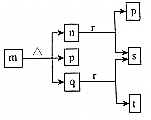 现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
 现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )| A. | 离子半径:W+>Z2- | |
| B. | Y的非金属性强于Z,故YX4的热稳定性强于q | |
| C. | n和少量t反应生成m,m还可以和t反应生成p和q | |
| D. | 把少量r投入到FeSO4溶液中,产生无色气体和白色沉淀 |
2.25℃,c(HCN)+c(CN-)=0.1mol•L-1的一组HCN和NaCN的混合溶液,溶液中c (HCN)、c(CN-)与pH的关系如图所示.下列有关离子浓度关系叙述正确的是( )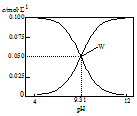

| A. | 将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(HCN) | |
| C. | pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1mol•L-1+c(OH-) | |
| D. | 将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=2c(HCN)+3c(H+) |
9.下列说法错误的是( )
| A. | 含金属元素的离子可能是阴离子 | |
| B. | 非金属元素组成的化合物可能含有离子键 | |
| C. | 化合物中所含化学键断裂时,一定发生了化学反应 | |
| D. | 用坩埚钳夹住仔细打磨过的铝箔在酒精灯上加热,融化的铝并不滴落 |
6.化学与杜会、生活密切相关.对下列现象或事实的解释错误的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的乙烯 |
| B | 高温能杀死流感病毒 | 病毒的蛋白质受热变性 |
| C | 用过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用Al(OH)3用作塑料的阻燃剂 | A(OH)3分解会吸收热量且产物不能燃烧 |
| A. | A | B. | B | C. | C | D. | D |
1.为研究硫酸铜的量对锌与稀硫酸反应氢气生成速率的影响,该同学设计了如下一系列实验.表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.下列说法正确的是( )
 | A | B | C | D | E | F |
| 4mol/L H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
| A. | V1=30,V6=10 | |
| B. | 反应一段时间后,实验A,E中的金属呈暗红色 | |
| C. | 加入MgSO4与Ag2SO4可以起与硫酸铜相同的加速作用 | |
| D. | 硫酸铜的量越多,产生氢气的速率肯定越快 |


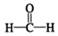 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$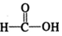 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$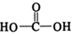 (H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.
(H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.