题目内容
20.A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大.下列有关叙述错误的是( )| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素A、C电负性大小关系为A>C |
分析 A、B、C、D四种元素,A元素是地壳中含量最多的元素,则A是O元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和,则其原子核外电子数=2×(2+8)=20,则B是Ca元素;C元素是第三周期第一电离能最小的元素,则C是Na元素;D元素在第三周期中第一电离能最大,则D是Ar元素,据此进行解答.
解答 解:A、B、C、D四种元素,A元素是地壳中含量最多的元素,则A是O元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和,则其原子核外电子数=2×(2+8)=20,则B是Ca元素;C元素是第三周期第一电离能最小的元素,则C是Na元素,D元素在第三周期中第一电离能最大,则D是Ar元素,
A.由上述分析可知,四种元素A、B、C、D分别为O、Ca、Na、Ar,故A正确;
B.元素O、Ca、Na两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等,故B正确;
C.O2-、Na+离子电子层结构相同,核电荷数越大离子半径越小,则离子半径:O2->Na+,故C错误;
D.金属性越强电负性越小,则电负性O>Na,故D正确;
故选C.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素是解题关键,注意掌握元素周期律内容、元素周期表结构,试题培养了学生的分析能力及综合应用能力.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
9.已知某烃A相对氢气的密度为35,且该烃不能使溴的四氯化碳溶液褪色,则A的可能结构共有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
10.化学与生活、生产密切相关.下列说法正确的是 ( )
| A. | 使用漂白精时滴加少量白醋,可提高漂白精的漂白效率 | |
| B. | 用乙醚从黄花篙的汁液中提取青篙素,应用了蒸馏原理 | |
| C. | 古代染坊常用草木灰浸取液来精炼丝绸,该浸取液的主要成分是烧碱 | |
| D. | “地沟油”可用于炼制航空煤油,因为地沟油经过蒸馏可以得到烃类煤油 |
8.我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是( )
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数少 | |
| C. | 5.2 g 26Al3+中所含的电子数约为1.2×1024 | |
| D. | 26Al和26Mg的质子数、中子数和核外电子数都不相同 |
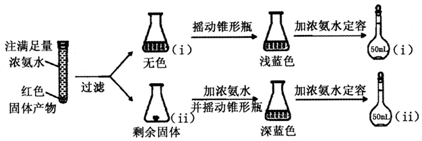
15. 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
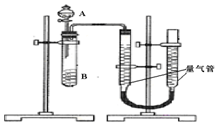
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)实验开始前需要检查气密性.分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要秒表(或计时器)(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
(4)X=5,4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4过量.
(5)2号反应中,H2C2O4的反应速率为0.00625mol/(L•s).
(6)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
结合实验目的与表中数据,你得出的结论是温度不是反应速率突然加快的原因.
(7)从影响化学反应速率的因素看,你的猜想还可能是催化剂的影响.若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
| 序号 | A溶液 | B溶液 |
| ① | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ② | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |
(2)实验开始前需要检查气密性.分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要秒表(或计时器)(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
(5)2号反应中,H2C2O4的反应速率为0.00625mol/(L•s).
(6)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
(7)从影响化学反应速率的因素看,你的猜想还可能是催化剂的影响.若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
12.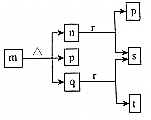 现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
 现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )| A. | 离子半径:W+>Z2- | |
| B. | Y的非金属性强于Z,故YX4的热稳定性强于q | |
| C. | n和少量t反应生成m,m还可以和t反应生成p和q | |
| D. | 把少量r投入到FeSO4溶液中,产生无色气体和白色沉淀 |
9.下列说法错误的是( )
| A. | 含金属元素的离子可能是阴离子 | |
| B. | 非金属元素组成的化合物可能含有离子键 | |
| C. | 化合物中所含化学键断裂时,一定发生了化学反应 | |
| D. | 用坩埚钳夹住仔细打磨过的铝箔在酒精灯上加热,融化的铝并不滴落 |
10.设NA为阿伏伽德罗常数值.下列叙述正确的是( )
| A. | 28gC2H4和CO的混合气体中含有的分子数为NA | |
| B. | 28gN2和6gH2充分反应,生成NH3的分子数为2NA | |
| C. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| D. | 0.1molFeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒 |
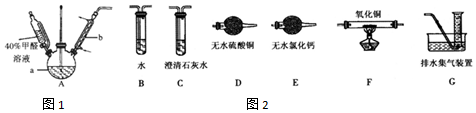
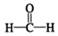 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$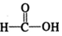 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$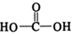 (H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.
(H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.