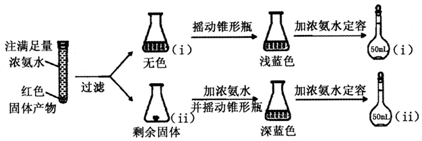
题目内容
14.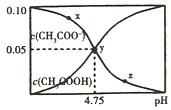 常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )
常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )| A. | 溶液的pH比较:x>y>z | |
| B. | 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| C. | 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点 | |
| D. | 该温度下,CH3COONa的Kb=10-4.75 |
分析 A.常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体发生反应生成CH3COOH和氯化钠,溶液PH减小;
B.y点c(CH3COO-)=c(CH3COOH)=0.05mol/L,溶液中存在等浓度的CH3COOH和CH3COONa,溶液酸性,醋酸电离大于醋酸根离子水解,c(CH3COO-)>c(Na+);
C.y点形成的是醋酸钠和醋酸的混合溶液宣传的是缓冲溶液,加入少量酸碱溶液PH变化不大;
D.平衡常数随温度变化,可以计算y点的电离平衡常数,此时c(CH3COO-)=c(CH3COOH).
解答 解:A.CH3COONa溶液中醋酸根离子水解溶液显碱性,促进水的电离,加入HCl气体,溶液碱性减弱水的电离程度增强,溶液的pH比较:x>y>z,故A正确;
B.y点c(CH3COO-)=c(CH3COOH)=0.05mol/L,溶液中存在等浓度的CH3COOH和CH3COONa,溶液酸性,醋酸电离大于醋酸根离子水解,c(CH3COO-)>c(Na+),溶液中离子浓度大小;c(CH3COO-)>c(Na+)=c(Cl-)>c(OH-),故B错误;
C.y点形成的是醋酸钠和醋酸的混合溶液宣传的是缓冲溶液,溶液中滴入一滴强酸抑制醋酸电离,滴入一滴强碱抑制醋酸根离子水解,所以加入少量酸碱溶液PH变化不大,溶液pH变化最小的是y点,故C正确;
D.y点溶液中存在电离平衡CH3COOH?CH3COO-+H+,此时c(CH3COO-)=c(CH3COOH),K=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=c(H+)=10-4.75,故D正确;
故选B.
点评 本题考查了图象变化分析、弱电解质电离平衡和盐类水解平衡的影响因素分析判断、平衡常数计算等,掌握基础是解题关键,题目难度中等.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案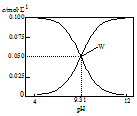
| A. | 将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(HCN) | |
| C. | pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1mol•L-1+c(OH-) | |
| D. | 将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=2c(HCN)+3c(H+) |
| A. | 含金属元素的离子可能是阴离子 | |
| B. | 非金属元素组成的化合物可能含有离子键 | |
| C. | 化合物中所含化学键断裂时,一定发生了化学反应 | |
| D. | 用坩埚钳夹住仔细打磨过的铝箔在酒精灯上加热,融化的铝并不滴落 |
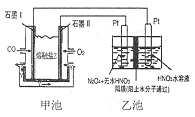 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )| A. | 石墨I是原电池的负极,发生氧化反应 | |
| B. | 甲池中的CO32-向石墨I极移动 | |
| C. | 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+ | |
| D. | 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.05mol |
| 选项 | 现象或事实 | 解释 |
| A | 用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的乙烯 |
| B | 高温能杀死流感病毒 | 病毒的蛋白质受热变性 |
| C | 用过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用Al(OH)3用作塑料的阻燃剂 | A(OH)3分解会吸收热量且产物不能燃烧 |
| A. | A | B. | B | C. | C | D. | D |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | X和Y能形成多种共价化合物 | |
| B. | 最简单氢化物的沸点:X>Y | |
| C. | 工业上常用电解Z的氯化物水溶液的方法制备Z单质 | |
| D. | Z和W的氧化物均能溶于Y的最高价氧化物对应的水化物溶液中 |
| A. | 能使酸性KMnO4溶液褪色 | B. | 能发生加聚反应 | ||
| C. | 能与乙醇发生酯化反应 | D. | 能与氢气发生加成反应 |
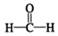 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$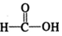 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$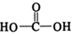 (H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.
(H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.