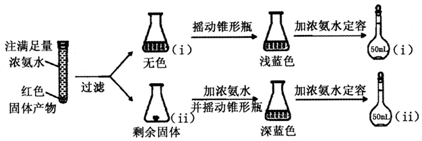
题目内容
15.设NA为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 1L2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| B. | 电解精炼铜时,若阴极得电子数为2NA,则阳极质量减少64g | |
| C. | 1mol聚苯乙烯分子有碳碳双键的数目为NA | |
| D. | 1molMg在空气中燃烧生成MgO(含少量Mg3N2)失去电子数为2NA |
分析 A、S2-能部分水解为HS-和H2S;
B、电解精炼铜时,阳极上放电的不只是铜;
C、聚苯乙烯分子中不含碳碳双键;
D、镁反应后变为+2价.
解答 解:A、S2-能部分水解为HS-和H2S,故溶液中的S2-、HS-和H2S总数为2NA个,S2-和HS-的总数小于2NA,故A错误;
B、电解精炼铜时,阳极上放电的不只是铜,故阴极得电子数为2NA,则阳极失去2mol电子,质量减少小于64g,故B错误;
C、苯乙烯加聚后所得的聚苯乙烯分子中不含碳碳双键,故C错误;
D、镁反应后变为+2价,故1mol镁反应后失去2mol电子即2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
5.某工业生产经过以下转化步骤:
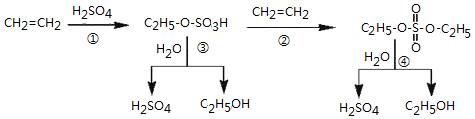
下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 该过程可以制取乙醇 | |
| B. | 已知C2H5-O-SO3H属于酯,所以该过程中①和②都是酯化反应 | |
| C. | 该过程中③和④是取代反应 | |
| D. | C2H5-O-SO3H具有酸性 |
10.化学与生活、生产密切相关.下列说法正确的是 ( )
| A. | 使用漂白精时滴加少量白醋,可提高漂白精的漂白效率 | |
| B. | 用乙醚从黄花篙的汁液中提取青篙素,应用了蒸馏原理 | |
| C. | 古代染坊常用草木灰浸取液来精炼丝绸,该浸取液的主要成分是烧碱 | |
| D. | “地沟油”可用于炼制航空煤油,因为地沟油经过蒸馏可以得到烃类煤油 |
1.已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:CH3CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$ CH3COONa+Cu2O↓+3H2O某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5mL 40%的乙醛溶液进行下列实验.
(1)上表中a、b应为B(填字母序号).
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
8.我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是( )
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数少 | |
| C. | 5.2 g 26Al3+中所含的电子数约为1.2×1024 | |
| D. | 26Al和26Mg的质子数、中子数和核外电子数都不相同 |
6.化学与杜会、生活密切相关.对下列现象或事实的解释错误的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的乙烯 |
| B | 高温能杀死流感病毒 | 病毒的蛋白质受热变性 |
| C | 用过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用Al(OH)3用作塑料的阻燃剂 | A(OH)3分解会吸收热量且产物不能燃烧 |
| A. | A | B. | B | C. | C | D. | D |


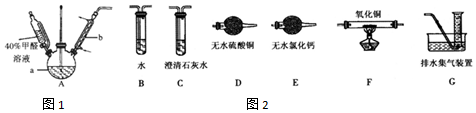
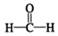 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$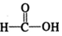 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$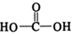 (H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.
(H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.