题目内容
14.某元素R,其原子最外层比次外层多一个电子,则其含氧酸的化学式不可能是( )| A. | HRO2 | B. | H3RO3 | C. | H2RO4 | D. | H2R4O7 |
分析 原子最外层比次外层多一个电子,应为B元素,最外层有3个电子,最高化合价为+3价,以此解答该题.
解答 解:原子最外层比次外层多一个电子,应为B元素,最外层有3个电子,最高化合价为+3价,
A.HRO2中R的化合价为+3价,故A不选;
B.H3RO3中R的化合价为+3价,故B不选;
C.H2RO4中R的化合价为+6价,故C选;
D.H2R4O7中R的化合价为+3价,故D不选.
故选C.
点评 本题考查原子结构与元素的性质,为高频考点,侧重于学生的分析能力的考查,注意把握原子结构特点以及常见元素的化合价,难度不大.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
2.软锰矿(主要成分为MnO2)可用于制备锰及其化合物.
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn.
(2)现代冶炼金属锰的一种工艺流程如图所示:

表为t℃时,有关物质的pKsp(注:pKsp=-lgKsp).
软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4=12MnSO4+CO2↑+18H2O
①该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度.
②滤液1的pH>(填“>”、“<”或“=”)MnSO4浸出液的pH.
③加入MnF2的主要目的是除去Ca2+(填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,计算该反应的平衡常数K=100(填数值).
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn.
(2)现代冶炼金属锰的一种工艺流程如图所示:

表为t℃时,有关物质的pKsp(注:pKsp=-lgKsp).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
①该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度.
②滤液1的pH>(填“>”、“<”或“=”)MnSO4浸出液的pH.
③加入MnF2的主要目的是除去Ca2+(填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,计算该反应的平衡常数K=100(填数值).
9.某溶液中含H+、SO42-、NO3-三种离子,其中H+、SO42-的物质的量浓度分别为7.0mol•L-1和2.0mol•L-1.取该溶液20mL,加入3.2g铜粉,加热使它们充分反应,产生的气体在标准状况下的体积约为( )
| A. | 0.75 L | B. | 0.336 L | C. | 1.5 L | D. | 0.448 L |
19.已知氮气和氧气发生化合反应的能量变化图象如图所示.下列推断正确的是( )
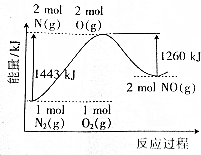

| A. | 氮气和氧气的反应是氧化还原反应,也是放热反应 | |
| B. | 1molNO分子被拆成原子要放出630kJ能量 | |
| C. | 1molN2(g)和1molO2(g)完全反应生成2molNO(g)时吸收183kJ能量 | |
| D. | 在酒精灯加热条件下,N2和O2能发生化合反应生成NO |
6.手机中使用的锂(Li)电池电板是新型的高能电池,以质量轻、电容量大而受到普遍重视,目前已制成多种功能的锂电池,某种锂电池的总反应可表示为Li+MnO2=LiMnO2,在此反应中锂元素的化合价变化0→+1,下列对锰元素的化合价变化判断正确的是( )
| A. | +4→+3 | B. | +2→+3 | C. | 0→+2 | D. | -4→-2 |
13. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | 水电离程度d<a<b<c | |
| B. | b点溶液的导电性比c点溶液的导电性弱 | |
| C. | a点KW的数值比c点KW的数值大 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
 ;取代反应
;取代反应 ;加成反应
;加成反应 ;取代反应
;取代反应 某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断. .
.