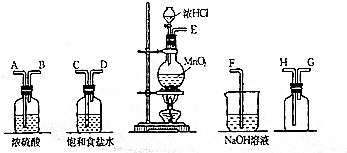
题目内容
9.下列电离方程式正确的是( )| A. | Ba(OH)2═Ba2++2OH- | B. | AlCl3═Al3++Cl3- | ||
| C. | H2SO4═2H++S6++4O2- | D. | Na2CO3═Na2++CO32- |
分析 强电解质完全电离,用等号,弱电解质部分电离,用可逆号,原子团不能拆,注意离子符号的书写.
解答 解:A、氢氧化钡为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-,故A正确;
B、AlCl3为强电解质,完全电离,电离方程式为:AlCl3=Al3++3Cl-,故B错误;
C、硫酸为强电解质,完全电离,电离生成氢离子和硫酸根离子,电离方程式:H2SO4=2H++SO42-,故C错误;
D、Na2CO3是强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故D错误;
故选A.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意电离方程式遵循原子个数、电荷数守恒规律.

练习册系列答案
相关题目
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | “84”消毒液中:K+、CO32-、Na+、I- | |
| B. | $\frac{K_W}{{C({H^+})}}$=1×10-13mol.L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 能使PH试纸显蓝色的溶液中:Na+、CH3COO-、Fe3+、SO42- | |
| D. | 通入足量的H2S后的溶液中:Al3+、Cu2+、SO42-、Cl- |
18.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.
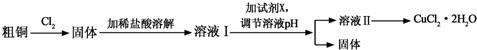
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
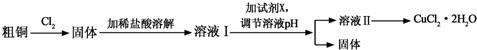
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
19.下列结论正确的是( )
| A. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,则金刚石比石墨稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则含20 g NaOH的稀溶液与稀醋酸恰好完全反应,放出的热量为28.7 kJ | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则碳的燃烧热等于110.5 kJ•mol-1 |

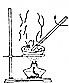
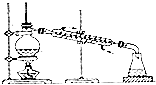
 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题:
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题: