题目内容
18.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.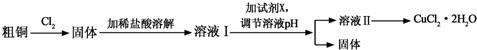
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
分析 粗铜中含有Fe,粗铜与氯气反应生成CuCl2和FeCl3,加热稀盐酸至固体完全溶解,溶液中含有CuCl2和FeCl3,盐酸能抑制铜离子和铁离子水解,从而得到溶液1;向溶液1中加入试剂X调节溶液pH至4-5,根据铁离子沉淀需要溶液pH值知,铁离子完全沉淀生成Fe(OH)3,铜离子不产生沉淀,过滤得到的固体2是Fe(OH)3,加入的X能和氢离子反应且不能引进新的杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,得到的溶液2为溶液CuCl2,经蒸发浓缩,冷却结晶可得到CuCl2晶体;
(1)①试剂X能和氢离子反应而提高溶液的pH值,且不能引进新的杂质;
②调节溶液pH时,要使铁离子完全沉淀但铜离子不能产生沉淀才能达到分离目的;
(2)由溶液Ⅱ制备CuCl2•2H2O,要抑制水解,不能蒸发结晶;
(3)向溶液Ⅱ中含有氯化铜,氯化铜和H2S反应生成盐酸和CuS,并结合Ksp计算;
(4)①碘遇淀粉试液变蓝色,所以要用淀粉检验碘单质;
②依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,根据反应的离子方程式计算分析.
解答 解:粗铜中含有Fe,粗铜与氯气反应生成CuCl2和FeCl3,加热稀盐酸至固体完全溶解,溶液中含有CuCl2和FeCl3,盐酸能抑制铜离子和铁离子水解,从而得到溶液1;向溶液1中加入试剂X调节溶液pH至4-5,根据铁离子沉淀需要溶液pH值知,铁离子完全沉淀生成Fe(OH)3,铜离子不产生沉淀,过滤得到的固体2是Fe(OH)3,加入的X能和氢离子反应且不能引进新的杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,得到的溶液2为溶液CuCl2,经蒸发浓缩,冷却结晶可得到CuCl2晶体;
(1)①试剂X能和氢离子反应而提高溶液的pH值,且不能引进新的杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,故答案为:ad;
②调节溶液pH时,要使铁离子完全沉淀但铜离子不能产生沉淀才能达到分离目的,所以其pH范围为3.2≤pH<4.7,故答案为:3.2≤pH<4.7;
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶、过滤、洗涤干燥,故答案为:冷却结晶;
(3)向溶液Ⅱ中含有氯化铜,氯化铜和H2S反应生成盐酸和CuS,盐酸是强酸,导致溶液中氢离子浓度增大,溶液的pH降低,离子方程式为H2S+Cu2+=CuS↓+2H+,若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为$\frac{1.2×1{0}^{-36}}{0.1}$=1.2×10-35mol/L,
故答案为:H2S+Cu2+=CuS↓+2H+;1.2×10-35;
(4)①碘遇淀粉试液变蓝色,所以要用淀粉溶液作指示剂,达到滴定终点时的溶液颜色变化为溶液由蓝色变为无色,故答案为:淀粉溶液;溶液由蓝色变为无色;
②由2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 2Na2S2O3~2Cu2+
2 2
cmol/L×V×10-3L cV×10-3mol
试样中CuCl2•2H2O的质量百分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$,
故答案为:$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$.
点评 本题考查物质制备实验,为高频考点,侧重考查学生实验操作及实验分析能力,涉及物质分离和提纯、基本实验操作、滴定实验及计算等知识点,侧重分析与实验能力的考查,题目难度中等.

| A. | Ba(OH)2═Ba2++2OH- | B. | AlCl3═Al3++Cl3- | ||
| C. | H2SO4═2H++S6++4O2- | D. | Na2CO3═Na2++CO32- |
| A. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═AlO2-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入少量氢氧化钙:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na2S溶液显碱性:S2-+H2O?HS-+OH- |
| A. | 使pH试纸显深红色的溶液:NH4+、Mg2+、Cl-、NO3- | |
| B. | 由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、HCO3-、SO42- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Fe2+、NO3-、AlO2- |
| A. | KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | Na[Al(OH)4]-溶液中通入过量CO2制Al(OH)3:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | NH3分子的电子式: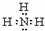 | ||
| C. | 铝原子的结构示意图: | D. | 聚丙烯的结构简式为: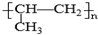 |
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
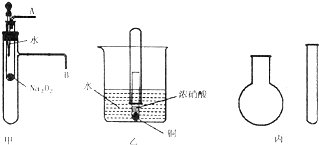 “套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题: 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: