题目内容
1.实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: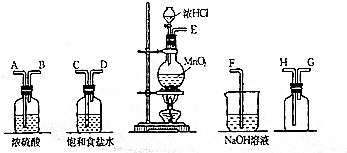
(1)按从左到右的顺序连接仪器,用接口字母按顺序连接为:
E→C→D→A→B→H→G→F.
(2)设计一个简单实验,验证所收集的氯气中是否含有空气用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体.
(3)某同学用2.0mol•L-1的盐酸和漂白粉反应也可以生成氯气,若产生2.24L(标准状况)氯气,发生反应的HCl为0.4mol.
分析 (1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)氯气可与氢氧化钠溶液反应,如含有空气,则与氢氧化钠反应后试管内有残留气体;
(3)依据方程式:4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,计算解答.
解答 解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,段导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气.
故答案为:C,D,A,B;
(2)氯气可与氢氧化钠溶液反应,如含有空气,则与氢氧化钠反应后试管内有残留气体,所以检验方法为:用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体;
故答案为:用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体;
(3)产生2.24L(标准状况)氯气,物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,则依据方程式可知:
4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
4 1
n 0.1mol
n=0.4mol,所以若产生2.24L(标准状况)氯气,发生反应的HCl为0.4mol;
故答案为:0.4.
点评 本题考查了氯气的实验室制备,熟悉制备原理及氯气的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
12.下列实验一定不会出现沉淀现象的是( )
| A. | CO2气体通入Na2SiO3溶液中 | B. | CO2气体通入饱和Na2CO3溶液中 | ||
| C. | SO2气体通入BaCl2溶液中 | D. | SO2气体通入Ba(OH)2溶液中 |
9.下列电离方程式正确的是( )
| A. | Ba(OH)2═Ba2++2OH- | B. | AlCl3═Al3++Cl3- | ||
| C. | H2SO4═2H++S6++4O2- | D. | Na2CO3═Na2++CO32- |
16.25℃时,向1L浓度均为1mol•L-1的弱酸(HA)及其盐(NaA)组成的混合溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入n(H+)或n(OH-)而变化的曲线如图.下列有关说法错误的是( )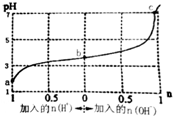

| A. | b点溶液中c(A-)>c(Na+)>c(HA) | |
| B. | 通入HCl后,c(HA)/c(A-)增大 | |
| C. | 当加入1 mol NaOH后,溶液中c(Na+)=c(A-) | |
| D. | a、b、c三点溶液中水的电离程度依次增大 |
6.下列反应的离子方程式正确的是( )
| A. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═AlO2-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入少量氢氧化钙:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na2S溶液显碱性:S2-+H2O?HS-+OH- |
13.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 使pH试纸显深红色的溶液:NH4+、Mg2+、Cl-、NO3- | |
| B. | 由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、HCO3-、SO42- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Fe2+、NO3-、AlO2- |
10.下列对应化学反应的离子方程式正确的是( )
| A. | KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | Na[Al(OH)4]-溶液中通入过量CO2制Al(OH)3:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
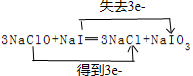 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3.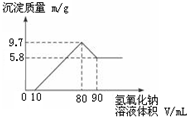 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入NaOH溶液体积的关系如图.
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入NaOH溶液体积的关系如图.