题目内容
8.有机物X是近年来合成的一种化合物,用现代物理方法测得X的相对分子质量为64,X含碳质量分数为93.8%,含氢质量分数为6.2%,X分子中有3种化学环境不同的氢原子和4种化学环境不同的碳原子;X分子中同时存在C-C、C=C和C≡C三种键,并发现其C=C键比普通的C=C键短,(1)X的分子式是C5H4
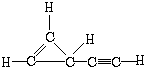
(2)请写出X可能的结构简式:
 .
.
分析 (1)X的相对分子质量为64,X含碳质量分数93.8%,含氢质量分数6.2%,二者质量分数之和为100%,故X属于烃,结合化学式中元素质量分数计算分子中C、H原子数目,进而确定分子式;
(2)结合X分子中同时存在C-C、C=C和C≡C三种键,有3种化学环境不同的氢原子和4种化学环境不同的碳原子,确定X可能结构简式.
解答 解:(1)X的相对分子质量为64,X含碳质量分数93.8%,含氢质量分数6.2%,C、H元素质量分数之和为100%,故X属于烃,则X分子中N(C)=$\frac{64×93.8%}{12}$=5、N(H)=$\frac{64-12×5}{1}$=4,故X的分子式为:C5H4,
故答案为:C5H4;
(2)其不饱和度为$\frac{5×2+2-4}{2}$=4,X分子中同时存在C-C、C=C和C≡C三种键,有3种化学环境不同的氢原子和4种化学环境不同的碳原子,则X的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物分子式确定的计算、限制条件同分异构体书写,X结构简式判断为易错点、难点,有利于培养学生的发散思维、分析解决问题的能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
18.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如图:下列说法不正确的是( )


| A. | 该过程中CeO2做催化剂 | |
| B. | 该过程实现了太阳能与化学能的相互转化 | |
| C. | 图中△H1+△H2+△H3﹦0 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH--2e-═CO32-+2H2O |
19.下列说法正确的是( )
| A. | 在NaHCO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | |
| B. | 在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在Na2CO3和NaHCO3两溶液中,离子种类不相同 | |
| D. | 在NaHCO3溶液中一定有c(Na+)>c(CO32-)>c(H+)>c(OH-) |
4. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
工业通过CO和H2化合来制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
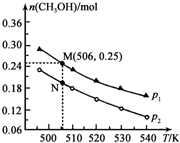
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.
1. 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金属可作为牺牲阳极保护法的阳极,保护Y金属 | |
| B. | Y金属不能从硫酸溶液中置换出氢气 | |
| C. | 三种金属的活泼性顺序为:Y>X>Z | |
| D. | Z和Y能构成电压最大的原电池 |
2.在一定条件下,Na2CO3溶液中存在如下反应:CO${\;}_{3}^{2-}$+H2O═HCO${\;}_{3}^{-}$+OH-下列说法中正确的是( )
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
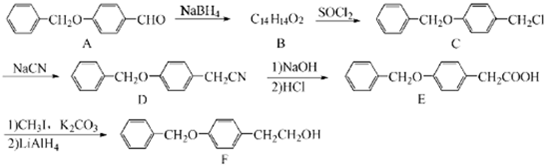
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应.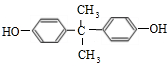
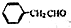 为原料制备
为原料制备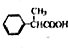 的合成路线示意图(无机试剂任用).合成路线示意图例如题干.
的合成路线示意图(无机试剂任用).合成路线示意图例如题干.

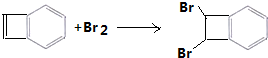
 +2CH3CH2OH$?_{△}^{浓硫酸}$
+2CH3CH2OH$?_{△}^{浓硫酸}$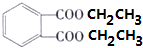 +2H2O
+2H2O