题目内容
13.在下列化合物中:①H2O ②Ne ③N2 ④CaCl2 ⑤KOH⑥酒精 ⑦Na2O2,用序号填写:既含有共价键又含有离子键的是⑤⑦;属于共价化合物的是①⑥.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:①H2O只含共价键的化合物;
②Ne是单原子分子,不存在化学键;
③氮气分子中只含共价键;
④氯化钙中只含离子键;
⑤氢氧化钾中既含离子键又含共价键;
⑥酒精中只含共价键;
⑦过氧化钠中既含离子键又含共价键;
既含有共价键又含有离子键的是 ⑤⑦;属于共价化合物的是①⑥;
故答案为:⑤⑦;①⑥.
点评 本题考查了化学键的判断,明确离子键和共价键的判断方法即可解答,注意稀有气体中不含化学键,只存在分子间作用力,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.X、Y、Z、W是原子序数依次增大的四种短周期元素,p、q、r是Y分别与X、Z、W形成的二元化合物,p与q反应生成盐及一种单质Y2,其中该盐与盐酸反应有气体生成,r与BaCl2溶液反应生成不溶于盐酸的白色沉淀.下列说法错误的是( )
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:W>X | |
| C. | 单质熔点:X>W>Y | |
| D. | q与p、r的化学键种类完全不同 |
4.有机物X的结构简式如图,下列说法正确的是( )
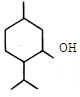

| A. | X分子式为C10H20O,它是环己醇的同系物 | |
| B. | X分子环上的一氯取代物只有三种 | |
| C. | X分子中至少有12个原子在同一平面上 | |
| D. | 在一定条件下,X能发生取代反应、氧化反应、聚合反应 |
1.已知氢化锂固体不导电,隔绝空气熔融时能导电,它跟水反应能生成一种相同条件下密度最小的气体.下列有关氢化锂的说法中,不正确的是( )
| A. | 氢化锂是一种电解质 | B. | LiH是离子晶体[ | ||
| C. | LiH是一种强氧化剂 | D. | LiH中Li+半径小于H-半径 |
8.核内中子数为N的R2+,质量数为A,则n g它的氧化物中所含质子的物质的量是( )
| A. | $\frac{n}{A+16}$(A-N+8)mol | B. | $\frac{n}{A+16}$(A-N+10)mol | C. | $\frac{n}{A}$ (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
2.向60mLNa2SO4溶液中加入BaCl2溶液,有关数据见表( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 30 | 60 | 100 | 120 |
| 沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
| A.混合前,BaCl2溶液的物质的量浓度为0.10mol•L-1 |
| B.混合前,Na2SO4溶液的物质的量浓度为0.15mol•L-1 |
| C.3号实验中沉淀的质量x为1.398g |
| D.完全沉淀60mL Na2SO4溶液消耗BaCl2溶液的体积为80mL |
| A. | A | B. | B | C. | C | D. | D |
9.下列分离或提纯物质的方法、操作正确的是( )
| A. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| D. | 将制得晶体转移到新制过滤器中用大量水进行洗涤 |
6.下列说法或做法正确的是( )
| A. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | 二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物 |

 、
、 (任写两种).
(任写两种).