题目内容
3.X、Y、Z、W是原子序数依次增大的四种短周期元素,p、q、r是Y分别与X、Z、W形成的二元化合物,p与q反应生成盐及一种单质Y2,其中该盐与盐酸反应有气体生成,r与BaCl2溶液反应生成不溶于盐酸的白色沉淀.下列说法错误的是( )| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:W>X | |
| C. | 单质熔点:X>W>Y | |
| D. | q与p、r的化学键种类完全不同 |
分析 p、q、r是Y分别与X、Z、W形成的二元化合物,与BaCl2溶液反应生成不溶于盐酸的白色沉淀,应生成硫酸钡,则r为SO3,可知Y为O元素,W为S元素,则p与q都为氧化物,反应生成盐及一种单质Y2,其中该盐与盐酸反应有气体生成,则p为CO2、q为Na2O2,X为C元素,Z为Na元素,以此解答该题.
解答 解:由以上分析可知X为C元素,Y为O元素、Z为Na元素,W为S元素,p为CO2、q为Na2O2,r为SO3,
A.对于离子来说,离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,则简单离子半径:W>Y>Z,故A正确;
B.非金属性S>C,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故B正确;
C.碳可形成原子晶体,S常温下为固体,氧气为气体,则单质熔点:X>W>Y,故C正确;
D.q与p、r都含有共价键,含有相同的化学键类型,故D错误.
故选D.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,注意把握物质的性质,把握推断的突破口,难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
3.原子序数依次递增的四种短周期元素可形成简单离子X2-、Y+、Z3+、M2-,下列说法错误的是( )
| A. | 工业上常采用电解法冶炼Z单质 | |
| B. | 气态氢化物的稳定性:H2X>H2M | |
| C. | 离子半径由大到小:M2->Y+>Z3+>X2- | |
| D. | X、Y形成的化合物中阳离子、阴离子个数比一定是2:1 |
4.下列离子方程式正确的是( )
| A. | 碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-═2Fe2++S↓ | |
| C. | 向Fe(NO3) 2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
11.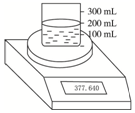 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
试计算样品中的质量分数,并估算最后溶液的pH.
 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | 370.000 | |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
15. 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
(1)进行实验i和ii:
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:SO32-+H2O?HSO3-+OH-.
②用离子方程式解释i中现象:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)继续进行实验iii:
为了说明产生上述现象的原因,补充实验:
向2mL蒸馏水中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色.
①补充实验的目的是排除水的稀释对溶液颜色变化造成的影响.
②用化学平衡移动原理解释iii中现象:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,溶液中大量的SO32-(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄.
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关.
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b.酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+.
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测.该现象是溶液变绿.
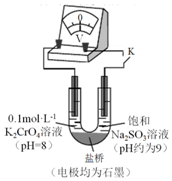
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大).
a.K闭合时,电压为x.
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y.
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变.
①上述实验说明:溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化.
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大.利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论.该实验方案是U型管左管中盛放pH=8浓度为0.1mol•L-1K2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z(z<y).
 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:已知:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
(1)进行实验i和ii:
| 序号 | 操作 | 现象 |
| i | 向2mL pH=2的0.05mol•L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mL pH=8的0.1mol•L-1 K2CrO4黄色溶液中 滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
②用离子方程式解释i中现象:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)继续进行实验iii:
| 序号 | 操作 | 现象 |
| iii | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
向2mL蒸馏水中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色.
①补充实验的目的是排除水的稀释对溶液颜色变化造成的影响.
②用化学平衡移动原理解释iii中现象:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,溶液中大量的SO32-(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄.
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关.
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b.酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+.
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测.该现象是溶液变绿.
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大).
a.K闭合时,电压为x.
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y.
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变.
①上述实验说明:溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化.
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大.利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论.该实验方案是U型管左管中盛放pH=8浓度为0.1mol•L-1K2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z(z<y).
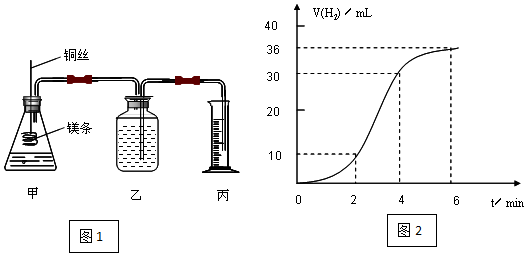
12.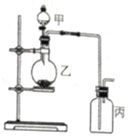 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )| 选项 | 实验目的 | 甲 | 乙 | 丙 |
| A | 制取并收集NO2 | 浓硝酸 | 铜片 | 水 |
| B | 制取并验证SO2具有漂白性 | 70%硫酸 | 亚硫酸钠 | 品红溶液 |
| C | 制取并验证氯气没有漂白性 | 浓盐酸 | 二氧化锰 | 干燥的红布条 |
| D | 比较HCl、H2CO3和H2SiO3酸性的强弱 | 盐酸 | 大理石 | 硅酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |