题目内容
9.下列分离或提纯物质的方法、操作正确的是( )| A. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| D. | 将制得晶体转移到新制过滤器中用大量水进行洗涤 |
分析 A、溶解、过滤的方法用于分离可溶性和难溶性物质的混合物;
B、蒸馏操作中,温度计测量的是挥发出的蒸汽的温度;
C、胶体和溶液均能通过滤纸;
D、用少量水洗涤制得的晶体.
解答 解:A、溶解、过滤的方法用于分离可溶性和难溶性物质的混合物,而BaSO4的BaCO3均难容,故不能从此方法,故A错误;
B、蒸馏操作中,温度计测量的是挥发出的蒸汽的温度,故温度计的水银球应处于蒸馏烧瓶的支管口处,故B正确;
C、胶体和溶液均能通过滤纸,故不能用过滤的方法来分离氯化钠溶液和淀粉胶体,故C错误;
D、晶体应该用少量水洗涤,否则导致制得的晶体会溶于水,造成损失,故D错误;
故选B.
点评 本题考查了胶体的提纯、蒸馏操作的注意事项等,题目难度不大,明确混合物的分离提纯的原理为解答关键,D为易错点,试题培养了学生的化学实验能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
15.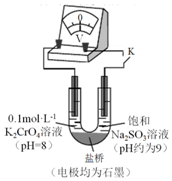 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
(1)进行实验i和ii:
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:SO32-+H2O?HSO3-+OH-.
②用离子方程式解释i中现象:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)继续进行实验iii:
为了说明产生上述现象的原因,补充实验:
向2mL蒸馏水中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色.
①补充实验的目的是排除水的稀释对溶液颜色变化造成的影响.
②用化学平衡移动原理解释iii中现象:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,溶液中大量的SO32-(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄.
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关.
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b.酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+.
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测.该现象是溶液变绿.
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大).
a.K闭合时,电压为x.
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y.
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变.
①上述实验说明:溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化.
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大.利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论.该实验方案是U型管左管中盛放pH=8浓度为0.1mol•L-1K2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z(z<y).
 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:已知:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
(1)进行实验i和ii:
| 序号 | 操作 | 现象 |
| i | 向2mL pH=2的0.05mol•L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mL pH=8的0.1mol•L-1 K2CrO4黄色溶液中 滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
②用离子方程式解释i中现象:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)继续进行实验iii:
| 序号 | 操作 | 现象 |
| iii | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
向2mL蒸馏水中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色.
①补充实验的目的是排除水的稀释对溶液颜色变化造成的影响.
②用化学平衡移动原理解释iii中现象:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,溶液中大量的SO32-(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄.
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关.
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b.酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+.
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测.该现象是溶液变绿.
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大).
a.K闭合时,电压为x.
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y.
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变.
①上述实验说明:溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化.
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大.利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论.该实验方案是U型管左管中盛放pH=8浓度为0.1mol•L-1K2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z(z<y).
16.有机物A是某种药物的中间体,其结构简式为: 关于有机物A的说法不正确的是( )
关于有机物A的说法不正确的是( )
 关于有机物A的说法不正确的是( )
关于有机物A的说法不正确的是( )| A. | A的分子式为C16H1403 | |
| B. | A可使酸性KMnO4溶液褪色和溴水褪色 | |
| C. | A苯环上的一氯代物同分异构体有2种 | |
| D. | A既可发生氧化反应和加成反应,又可以发生取代反应 |
4.一定量的甲烷燃烧后得到的产物为二氧化碳、一氧化碳和水蒸气,将产生的气体按顺序通过装有无水氯化钙和氢氧化钠的硬质玻璃管,氢氧化钠管的质量增加了4.4g,则甲烷在标准状况下的体积是多少,无水氯化钙的质量增加了 ( )
| A. | 0.56L 1.8g | B. | 1.12L 3.6g | C. | 2.24L 1.8g | D. | 2.24L 3.6g |
1.我国提取中草药有效成分的常用溶剂有:水;或亲水性溶剂(如乙醇,与水互溶);或亲脂性溶剂(如乙醚,与水不互溶).诺贝尔奖获得者屠呦呦及其团队在提取青蒿素治疗疟疾过程中,记录如下:青蒿素的水煎剂无效;乙醇提取物的效用为30%~40%;乙醚提取物的效用为95%.下列推测不合理的是( )
| A. | 青蒿素在水中的溶解度很小 | B. | 青蒿素含有亲脂的官能团 | ||
| C. | 在低温下提取青蒿素,效果会更好 | D. | 乙二醇提取青蒿素的能力强于乙醚 |
18.某有机物X的结构简式如图所示,下列有关说法不正确的是( )


| A. | X分子中含有三种官能团 | |
| B. | 可用酸性高锰酸钾溶液区别苯和X | |
| C. | X在一定条件下能发生加成、加聚、取代、氧化等反应 | |
| D. | 在催化剂的作用下,1 mol X最多能与5 mol H2加成 |
19.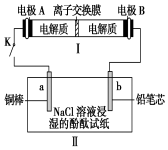 如图所示装置Ⅰ是可充电电池.已知:该充电电池充电时的反应为:
如图所示装置Ⅰ是可充电电池.已知:该充电电池充电时的反应为:
Na2Sx+3NaBr→2Na2Sy+NaBr3,闭合开关K时,装置Ⅱ中b极附近变红色.下列说法正确的是( )
 如图所示装置Ⅰ是可充电电池.已知:该充电电池充电时的反应为:
如图所示装置Ⅰ是可充电电池.已知:该充电电池充电时的反应为:Na2Sx+3NaBr→2Na2Sy+NaBr3,闭合开关K时,装置Ⅱ中b极附近变红色.下列说法正确的是( )
| A. | 闭合开关K时,电极B上发生的反应是:Br3-+2e-═3Br- | |
| B. | 闭合开关K时,I中Na+移向A极,II中Na+移向a极 | |
| C. | 当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112 mL | |
| D. | 闭合开关K时,Ⅱ中发生反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |