题目内容
6.下列有关表述正确的有几句(1)-OH 与
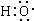
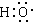 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同(2)HCN分子的结构式:H-C≡N
(3)Cl-的离子结构示意图:

(4)CO2的分子模型示意图:

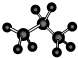
(5)丙烷的分子比例模型:
(6)次氯酸的电子式为
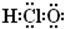
(7)
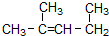 名称为1,3-二甲基-2-丁烯
名称为1,3-二甲基-2-丁烯(8)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4-
(9)乙炔的结构式 CH≡CH( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 (1)-OH与 分别为羟基的结构简式和电子式;
分别为羟基的结构简式和电子式;
(2)书写结构简式时注意C≡N三价不能省略;
(3)Cl-有17个质子;
(4)二氧化碳为直线型结构;
(5)丙烷为饱和烷烃,存在碳碳单键和碳氢单键,四个碳原子在一条连上;
(6)次氯酸中氧原子分别与氯原子和氢原子共用1对电子;
(7) 最长碳链为5个碳原子,从右端开始编号,2号碳上有个甲基,和双键,据此命名;
最长碳链为5个碳原子,从右端开始编号,2号碳上有个甲基,和双键,据此命名;
(8)熔化时NaHSO4的时候,只电离出钠离子与硫酸氢根离子;
(9)最简式为有机物中各种原子的个数最简比.
解答 解:(1))-OH与 分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故正确;
分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故正确;
(2)HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故正确;
(3)Cl-的离子结构示意图 ,故错误;
,故错误;
(4)二氧化碳为直线型结构,故错误;
(5)丙烷为饱和烷烃,存在碳碳单键和碳氢单键,四个碳原子在一条连上,结构型示意图: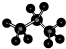 ,故错误;
,故错误;
(6)次氯酸的电子式为: ,故错误;
,故错误;
(7) 名称为2-甲基-2-戊烯,故错误;
名称为2-甲基-2-戊烯,故错误;
(8)熔化时NaHSO4的电离方程式为NaHSO4═Na++HSO4-,故正确;
(9)乙炔的最简式为:CH,故错误;
正确的为:(1)(2)(8),
故选A.
点评 本题考查了化学用语的使用,属于基础知识的考查,题目难度不大,注意有机物系统命名方法.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
17.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且$\frac{c(C{1}^{-})}{c(C1{O}^{-})}$的值与温度高低有关.当n(KOH)=a mol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(Cl-)}{c(ClO-)}$=2,则溶液中$\frac{c(C1{O}^{-})}{c(C1{O}_{3}^{-})}$=5 | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$ a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$ a mol≤ne≤$\frac{5}{6}$ a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$a mol |
1.草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是还原Fe3+、Co3+为Fe2+、Co2+.
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{{c({M{g^{2+}}})}}{{c({C{a^{2+}}})}}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,在滤液II中适宜萃取的pH为3.0~3.5左右.
(6)已知:NH3•H2O?NH4++OH- Kb=1.8×10-5;
H2C2O4?H++HC2O4- Ka1=5.4×10-2;HC2O4-?H+C2O42- Ka2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4(或CoO•Co2O3)


已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{{c({M{g^{2+}}})}}{{c({C{a^{2+}}})}}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,在滤液II中适宜萃取的pH为3.0~3.5左右.
(6)已知:NH3•H2O?NH4++OH- Kb=1.8×10-5;
H2C2O4?H++HC2O4- Ka1=5.4×10-2;HC2O4-?H+C2O42- Ka2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4(或CoO•Co2O3)

11.下列实验能获得成功的是( )
| A. | 向苯酚中加浓溴水观察沉淀 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 苯与浓溴水反应制取溴苯 | |
| D. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
12.能正确表示下列反应的离子方程式是( )
| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |